题目内容
【题目】下列物质:①Ar ②Na2O2 ③AlCl3 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
(1)只存在共价键的是___,不存在化学键的是_____,离子化合物有_______
(2)由离子键和极性键构成的物质是__________
(3)N2的电子式为_____ HClO的电子式为________NH4Cl的电子式为___________
(4)用电子式表示MgF2的形成过程___________
【答案】③④⑤ ① ②⑥⑦ ⑦ ![]()
![]()
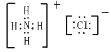
![]()
【解析】
①Ar中不含化学键;②Na2O2为离子化合物,由钠离子和过氧根离子构成,其含有离子键和非极性共价键;③AlCl3为共价化合物,其含有极性共价键;④HClO为共价化合物,其含有极性共价键;⑤N2中含有非极性共价键;⑥MgF2为离子化合物,由镁离子、氟离子构成,其含有离子键;⑦NH4Cl为离子化合物,由铵根离子和氯离子构成,其含有极性共价键和离子键。
(1)综上分析,③④⑤只存在共价键,①Ar不存在化学键,②⑥⑦为离子化合物。
(2) NH4Cl为离子化合物,由铵根离子和氯离子构成,铵根离子中含有极性共价键,铵根离子和氯离子间为离子键,则由离子键和极性键构成的物质是⑦NH4Cl。
(3)N2分子中氮原子之间为叁键,其电子式为![]() ;HClO中H原子与O原子共用一对电子,O原子与Cl原子共用一对电子,电子式为
;HClO中H原子与O原子共用一对电子,O原子与Cl原子共用一对电子,电子式为![]() ;NH4Cl由铵根离子和氯离子构成,其电子式为
;NH4Cl由铵根离子和氯离子构成,其电子式为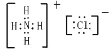 。
。
(4)氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为![]() 。
。

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目