题目内容
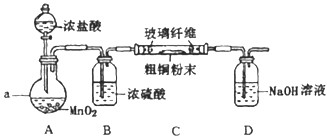
9.某学生用如图所示装置证明溴和苯的反应是取代反应而不是加成反应.主要实验步骤如下:(1)检查气密性,然后向烧瓶中加入一定量的苯和液溴.
(2)向锥形瓶中加入某溶液适量,小试管中加入CCl4,并将右边的长导管口浸入CCl4液面下.
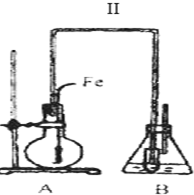
(3)将A装置中的纯铁丝小心向下插入混合液中.
请填写下列空白:
①装置B的锥形瓶中小试管内CCl4的作用是吸收挥发的溴蒸气;小试管外的液体是(填名称冷水,其作用是吸收HBr气体.
②反应后,向锥形瓶中滴加(填化学式)AgNO3溶液,现象是生成淡黄
 色沉淀,其作用是检验溴离子;装置(Ⅱ)还可起到的作用是防倒吸.
色沉淀,其作用是检验溴离子;装置(Ⅱ)还可起到的作用是防倒吸.
分析 由图可知,A中发生 +Br2$\stackrel{Fe}{→}$+HBr,装置B的锥形瓶中小试管内CCl4吸收溴、溴苯,小试管外的液体为水,吸收HBr气体,然后滴加硝酸银检验溴离子,以此来解答.
+Br2$\stackrel{Fe}{→}$+HBr,装置B的锥形瓶中小试管内CCl4吸收溴、溴苯,小试管外的液体为水,吸收HBr气体,然后滴加硝酸银检验溴离子,以此来解答.
解答 解:若发生加反应不生成副产物,若发生取代反应生成HBr,
(1)装置B的锥形瓶中小试管内CCl4的作用是吸收挥发的溴蒸气,小试管外的液体是水,其作用是吸收HBr气体,
故答案为:吸收挥发的溴蒸气;冷水;吸收HBr气体;
(2)反应后,向锥形瓶中滴加AgNO3溶液,HBr与硝酸银反应生成AgBr沉淀,现象是有淡黄色沉淀生成,其作用是检验溴离子,可知发生取代反应,HBr极易溶于水,水与气体不能直接接触,则装置B还可起到的作用是防倒吸,
故答案为:AgNO3;检验溴离子;防倒吸.
点评 本题考查实验装置综合及有机物的制备实验,为高频考点,把握反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列操作能达到目的是( )
| 选项 | 目的 | 操作 |
| A | 配制100mL 1.0mol/L MgSO4溶液 | 将12.0g MgSO4固体倒进100mL容量瓶中,然后加入100mL蒸馏水 |
| B | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| C | 制备Fe(OH)3胶体 | 向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间加热煮沸 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| A. | A | B. | B | C. | C | D. | D |
19.下列图示箭头方向表示与某种常见试剂在通常条件下(不含电解)发生转化,其中6步转化均能一步实现的一组物质是
( )
| 选项 | W | X | Y | Z |  |
| A | N2 | NH3 | NO | NO2 | |
| B | Na | Na2O2 | NaOH | Na2CO3 | |
| CC | Cu | CuSO4 | CuCl2 | Cu(OH)2 | |
| D | Al | Al2(SO4)3 | AlCl3 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |