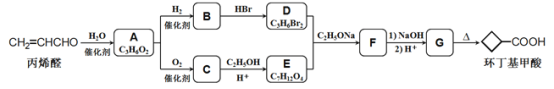
题目内容
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是

A. 已知H3FeO4+的电离半衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pII=4吋,溶液中![]()
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O
D. pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ)
【答案】A
【解析】A、根据H3FeO4+的电离常数分析,其电离平衡常数K2=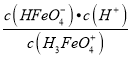 =4.8×10-4,则当pH=4时,溶液中
=4.8×10-4,则当pH=4时,溶液中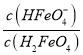 =
=![]() =4.8,选项A错误;B、pH≥9时,的物质的量分数接近100%,则为获得尽可能纯净的高铁酸盐,应控制pH≥9,选项B正确;C、向pH=5的高铁酸盐溶液中(根据图示可以看出其中含有HFeO4ˉ)加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O,选项C正确;D、由图象纵坐标可知pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ),选项D正确。答案选A。
=4.8,选项A错误;B、pH≥9时,的物质的量分数接近100%,则为获得尽可能纯净的高铁酸盐,应控制pH≥9,选项B正确;C、向pH=5的高铁酸盐溶液中(根据图示可以看出其中含有HFeO4ˉ)加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O,选项C正确;D、由图象纵坐标可知pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ),选项D正确。答案选A。

练习册系列答案
相关题目