题目内容
【题目】(1)与CO互为等电子体的分子和离子分别为______和______。
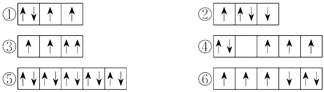
(2)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
(3)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
【答案】 N2 C22- 或 CN- ③ ②④⑥ 1s22s22p63s23p4 H2SO4 ①④⑥③②⑤
【解析】分析:(1)原子数和价电子数分别都相等的互为等电子体;
(2)泡利原理是指在一个原子轨道中,最多只能容纳2个电子,并且这两个电子的自旋方向相反。洪特规则是指当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据1个轨道,并且自旋方向相同。
(3)根据激发态原子核外电子排布式知该元素核外有16个电子,根据能量最低原理分析其基态原子核外电子排;
(4)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……。
详解:(1)原子数和价电子数分别都相等的互为等电子体,则与CO互为等电子体的分子和离子分别为N2、C22-或CN-。
(2)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理,所以违反泡利不相容原理的有③;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则,所以违反洪特规则的有②④⑥;
(3)根据激发态原子核外电子排布式知该元素核外有16个电子,为S元素;根据能量最低原理,其基态原子核外电子排是1s22s22p63s23p4;S元素最外层有6个电子,所以最高价是+6价,最高价氧化物对应水化物的化学式是H2SO4;
(4)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……,因此多电子原子的原子轨道按轨道能量由低到高顺序是①④⑥③②⑤。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是__________
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
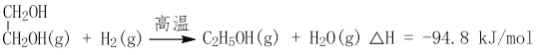
获取乙二醇的反应历程可分为如下2步:
I. 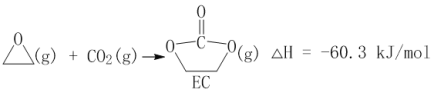
II.EC加氢能生成乙二醇与甲醇。
①步骤II的热化学方程式是__________;
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/℃ | EC转化率/ % | 产率/% | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是__________。温度升高到220℃时,乙二醇的产率反而降低,原因是__________
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极 a 接电源的__________极(填“正”或“负”),生成甲醇的电极反应式是__________
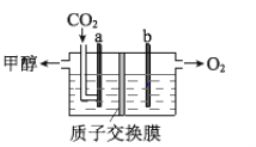
(4)CO2较稳定、能量低。为实现CO2的高效使用,下列研究方向合理的是__________(填序号)。
a.降低CO2参与反应的速率和比例
b.利用电能、光能或热能预先活化CO2分子
c.选择高效的催化剂降低反应条件