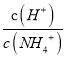题目内容
【题目】磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1)基态Ni原子的价电子排布式是___。
(2)丁二酮肟(结构简式如图1所示)中碳原子的杂化方式为___。丁二酮肟中C、N、O第一电离能由大到小的顺序为___。1mol丁二酮肟分子中含有σ键的数目为___mol。

(3)Ni(CO)4是一种无色液体,与CO互为等电子体的二价阴离子的电子式为___。
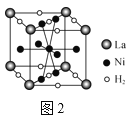
(4)图2是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa的合金含有Ni的数目为___。
【答案】3d84s2 sp2和sp3 N>O>C 15 ![]() 5mol或3.01×1024
5mol或3.01×1024
【解析】
(1)基态Ni原子价电子为3d、4s能级上电子;
(2)该分子中甲基上C原子价层电子对个数是4、连接甲基的碳原子价层电子对个数是3,根据价层电子对互斥理论判断C原子杂化类型;同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素;共价单键为σ键、共价双键中含有一个σ键和一个π键,1个丁二酮肟分子中含有15个σ键;
(3)与CO互为等电子体的二价阴离子中原子个数是2、价电子数是10,符合条件的阴离子为C22﹣;
(4)该晶胞中La原子个数=8×![]() =1、Ni原子个数=4×
=1、Ni原子个数=4×![]() +1+4×
+1+4×![]() =5,则该晶胞中La、Ni原子个数之比为1:5。
=5,则该晶胞中La、Ni原子个数之比为1:5。
(1)基态Ni原子价电子为3d、4s能级上电子,其价电子排布式为3d84s2;
(2)该分子中甲基上C原子价层电子对个数是4、连接甲基的碳原子价层电子对个数是3,根据价层电子对互斥理论判断C原子杂化类型,前者为sp3、后者为sp2;同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能N>O>C;共价单键为σ键、共价双键中含有一个σ键和一个π键,1个丁二酮肟分子中含有15个σ键,则1mol该物质中含有15molσ键;
(3)与CO互为等电子体的二价阴离子中原子个数是2、价电子数是10,符合条件的阴离子为C22﹣,该离子与氮气也互为等电子体,根据氮气分子的电子式知其电子式为![]() ;
;
(4)该晶胞中La原子个数=8×![]() =1、Ni原子个数=4×
=1、Ni原子个数=4×![]() +1+4×
+1+4×![]() =5,则该晶胞中La、Ni原子个数之比为1:5,所以含1 mol La的合金含有Ni的数目为3.01×1024。
=5,则该晶胞中La、Ni原子个数之比为1:5,所以含1 mol La的合金含有Ni的数目为3.01×1024。

 阅读快车系列答案
阅读快车系列答案