题目内容
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇水气时发烟生成(HSiO)2O等,写出该反应的化学方程式___。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=___kJ·mol-1。
(3)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
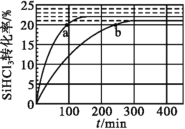
①343K时反应的平衡转化率α=___%。
②比较a、b处反应速率大小:va___vb(填“大于”“小于”或“等于”)。
【答案】2SiHCl3+3H2O=(HSiO)2O+6HCl +114 22 大于
【解析】
该反应为非氧化还原反应,由原子守恒进行配平即可;根据盖斯定律,书写热化学方程式;依据图像可以看出343K时反应的平衡转化率,从影响速率条件进行分析。
(1)由题中信息可知,SiHCl3在常温常压下为易挥发的无色透明液体,遇水气时发烟生成(HSiO)2O,该反应为非氧化还原反应,由原子数目守恒进行配平,方程式为2SiHCl3+3H2O=(HSiO)2O+6HCl,故答案为:2SiHCl3+3H2O=(HSiO)2O+6HCl;
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol-1
把第一个反应乘以3后和第二个反应相加,即可得反应4SiHCl3(g)=SiH4(g)+3SiCl4(g),由盖斯定律可得其ΔH=3ΔH1+ΔH2=3×48 kJ·mol-1+(30 kJ·mol-1)=+144kJ·mol-1,故答案为:+144;
(3)①温度越高,反应速率越快,越先达到平衡,所以图像中a点所在的曲线温度高,即为343K下的曲线,从曲线可以看出,平衡时SiHCl3的转化率为22%,故答案为:22;
②a、b两处反应物的转化率相等,所以各物质的浓度相等,而a处温度高于b处温度,温度越高,反应速率越快,所以反应速率:va大于vb,故答案为:大于。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案