题目内容
将12.8 g铜跟一定量的浓硝酸反应,待铜耗尽时,共产生气体5.6 L(标准状况下)。计算被还原的HNO3的物质的量是多少?
0.25 mol
事实上,铜与浓硝酸反应时,浓硝酸的质量分数在不断降低,后来发生的反应,应是铜与稀硝酸的反应,生成的5.6 L气体,也应该是NO2与NO的体积之和。
根据氮原子守恒的方法解此题:
2HNO3 Cu(NO3)2
Cu(NO3)2
1HNO3 1NO
1NO
1HNO3 1NO2
1NO2
被还原的硝酸应该是生成气体的硝酸。
n(NO)+n(NO2)=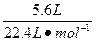 ="0.25" mol。
="0.25" mol。
所以被还原硝酸的物质的量为0.25 mol。
根据氮原子守恒的方法解此题:
2HNO3
 Cu(NO3)2
Cu(NO3)21HNO3
 1NO
1NO1HNO3
 1NO2
1NO2被还原的硝酸应该是生成气体的硝酸。
n(NO)+n(NO2)=
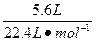 ="0.25" mol。
="0.25" mol。所以被还原硝酸的物质的量为0.25 mol。

练习册系列答案
相关题目