题目内容
【题目】取某浓度的NaOH溶液10mL,向其中通入一定量的CO2,再向所得溶液中逐滴加入![]() 的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,请回答:
的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,请回答:
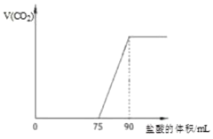
(1)原NaOH溶液的物质的量浓度为__mol·L-1;
(2)原NaOH溶液通入CO2后,所得溶液中的溶质为(写化学式)__;其物质的量之比为__。
【答案】0.9 NaOH和Na2CO3 4:1
【解析】
(1)先向氢氧化钠溶液中通入CO2,后向溶液中滴加盐酸,当CO2完全放出时,溶液的溶质是NaCl,该反应的实质是盐酸和氢氧化钠反应生成NaCl,根据盐酸的物质的量计算氢氧化钠溶液的浓度;
(2)与CO2反应,反应后溶液的溶质可能是NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、或NaHCO3,Na2CO3+HCl= NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,消耗的盐酸的体积相等,0-75mL没有气体生成,消耗的盐酸体积大于75-90mL消耗的盐酸的体积,因此可知溶液中的溶质为NaOH和Na2CO3,反应的离子方程式为OH-+H+=H2O,CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑, NaHCO3完全反应生成CO2消耗盐酸的体积为90mL-75mL=15mL,那么Na2CO3转化为NaHCO3消耗盐酸的体积也为15mL,因此NaOH完全反应消耗盐酸的体积为75mL-15mL=60mL,结合n=cV计算物质的量之比。
(1)先向氢氧化钠溶液中通入CO2,后向溶液中滴加盐酸,当CO2完全放出时,溶液的溶质是NaCl,该反应的实质是盐酸和氢氧化钠反应生成NaCl,盐酸和氢氧化钠的物质的量之比为1:1,设NaOH的物质的量浓度为xmol/L,加入90mL盐酸时CO2的体积最大,此时溶液为氯化钠溶液,根据Cl-和Na+守恒,可得n(NaOH)=n(NaCl)=n(HCl)=0.09L×0.1mol/L=0.009mol,那么c(NaOH)=![]() =0.9mol/L,溶液具有均一性,因此原NaOH溶液的物质的量浓度为0.9mol/L;
=0.9mol/L,溶液具有均一性,因此原NaOH溶液的物质的量浓度为0.9mol/L;
(2)与CO2反应,反应后溶液的溶质可能是NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、或NaHCO3,Na2CO3+HCl= NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,消耗的盐酸的体积相等,0-75mL没有气体生成,消耗的盐酸体积大于75-90mL消耗的盐酸的体积,因此可知溶液中的溶质为NaOH和Na2CO3,反应的离子方程式为OH-+H+=H2O,CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑, NaHCO3完全反应生成CO2消耗盐酸的体积为90mL-75mL=15mL,那么Na2CO3转化为NaHCO3消耗盐酸的体积也为15mL,因此NaOH完全反应消耗盐酸的体积为75mL-15mL=60mL,根据n=cV可知NaOH和Na2CO3的物质的量之比为60:15=4:1。

【题目】如表陈述Ⅰ、Ⅱ均正确,且两者在反应原理上相似的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 将 |
|
B |
|
|
C | 玻璃试剂瓶可用于盛放氢氟酸 | 石英坩埚不能用于熔化NaOH |
D |
|
|
A.AB.BC.CD.D
【题目】某化学小组以苯甲酸(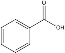 )为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
密度/g·cm-3 | 0.792 | 1.2659 | 1.0888 |
相对分子质量 | 32 | 122 | 136 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约为0.79g·cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是______________;写出苯甲酸与甲醇反应的化学方程式:______________。
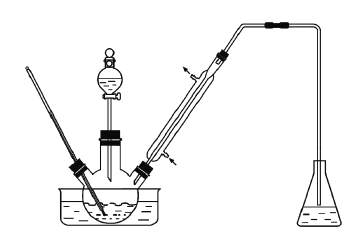
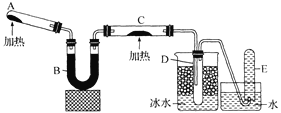
(2)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用__________装置(填“甲”或“乙”)

(3)反应物CH3OH应过量,理由是______________。
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称a______________,b______________。
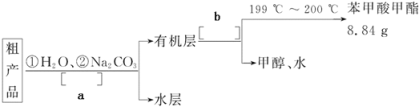
(5)通过计算,苯甲酸甲酯的产率为______________