题目内容
【题目】(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
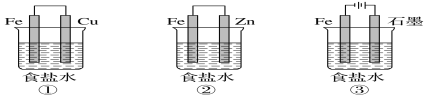
为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为_________。
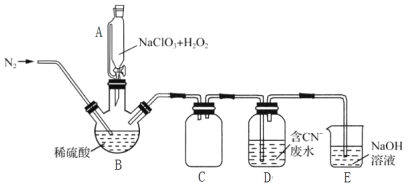
(2)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为__________。
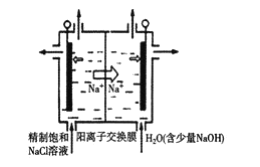
(3)纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。

①上述装置中D电极应连接肼燃料电池的________极(填“A”或“B”)。
②该电解池的阳极反应式为_______。
③当反应生成14.4 g Cu2O时,至少需要肼________mol。
【答案】②③ 2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑ 作电解质溶液(或导电) B 2Cu-2e-+2OH-=Cu2O+H2O 0.05
2OH-+Cl2↑+H2↑ 作电解质溶液(或导电) B 2Cu-2e-+2OH-=Cu2O+H2O 0.05
【解析】
(1)根据原电池和电解池的原理回答;
(2)根据原电池的形成条件回答;
(3)根据燃料电池和氧化还原反应的原理回答;
(1)①装置为原电池,铁为负极,被腐蚀;
②装置为原电池,锌为负极,被腐蚀,铁作正极被保护;
③装置为电解池,铁作阴极被保护;
装置③发生的是电解饱和食盐水的反应,阳极是氯离子失电子生成氯气,阴极是氢离子得电子发生还原反应,总的离子反应为2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
(2)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,利用原电池原理,用铝置换出银,食盐水的作用是作电解质溶液,形成原电池;
(3)燃料电池正极通氧化剂,负极通燃料,即A极为负极,B极为正极,图乙为电解池装置,电解目的为制备Cu2O,则D极作阳极,接电池正极(B极),铜被氧化,阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O ,根据电极反应2Cu-2e-+2OH-=Cu2O+H2O和N2H4-4e-+4OH-=N2↑+4H2O可知,2Cu2O~ N2H4,则14.4 g Cu2O的物质的量为n=![]() =
=![]() =0.1mol,消耗肼的物质的量为0.05mol。
=0.1mol,消耗肼的物质的量为0.05mol。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案