题目内容
用98%、密度为1.84g/cm3的浓H2SO4配制1mol/L的稀硫酸90mL,下列仪器必须使用的是: ①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤250mL容量瓶;⑥胶头滴管;⑦玻璃棒;⑧100mL容量瓶 ( )
A ①③④⑤⑥⑦ B ①③⑤⑥⑦ C ①③④⑤⑥⑦ D ②③⑥⑦⑧
A ①③④⑤⑥⑦ B ①③⑤⑥⑦ C ①③④⑤⑥⑦ D ②③⑥⑦⑧
D
略

练习册系列答案
相关题目
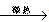 NaHSO4+HNO3↑,制取HNO3时,下图所列装置中最适合的是
NaHSO4+HNO3↑,制取HNO3时,下图所列装置中最适合的是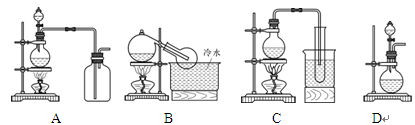


 器示意图在方框内画出乙烯的发生装置(夹持装置不必画出,需要加热的仪器下方用△标出)。
器示意图在方框内画出乙烯的发生装置(夹持装置不必画出,需要加热的仪器下方用△标出)。 会产生黑烟,实验时若要迅速熄灭火焰,最简单、安全的操作方法是: 。
会产生黑烟,实验时若要迅速熄灭火焰,最简单、安全的操作方法是: 。
 出实验室制乙酸乙酯的化学方程式(要标出氧-18示踪原子)
出实验室制乙酸乙酯的化学方程式(要标出氧-18示踪原子)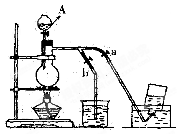
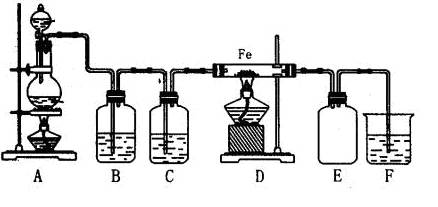
 。(填:如何操作a、b止水夹,下同),
。(填:如何操作a、b止水夹,下同),

 mL D.200mL
mL D.200mL ▲ 。
▲ 。 水至刻度处
水至刻度处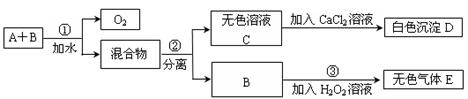
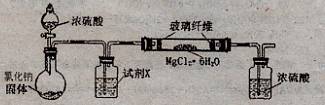
 后,过滤;
后,过滤;