题目内容
(14分)工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂废气SO2,并制备MnSO4.H2O晶体,其工艺流程如下:
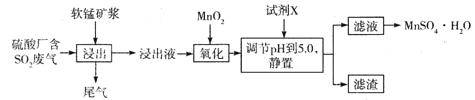
已知:①浸出液的pH<2,且阳离子主要是Mn2+,以及少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:

请回答下列问题:
(1)浸出液pH <2的原因可能是_________________________________________。
(2)加入MnO2,氧化时溶液中反应的离子方程式为________________________ ,若流程中取消“加入MnO2”,对上述流程的影响是________________________________________。
(3)试剂X________(填“能”或“不能”)选用氢氧化锰,试说明理由:____________
______________________________________________________________________________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是______________________
______________________________________________________________________________。
(5)从滤液中提取MnSO4.H2O晶体的操作是____________________________________。

已知:①浸出液的pH<2,且阳离子主要是Mn2+,以及少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:

请回答下列问题:
(1)浸出液pH <2的原因可能是_________________________________________。
(2)加入MnO2,氧化时溶液中反应的离子方程式为________________________ ,若流程中取消“加入MnO2”,对上述流程的影响是________________________________________。
(3)试剂X________(填“能”或“不能”)选用氢氧化锰,试说明理由:____________
______________________________________________________________________________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是______________________
______________________________________________________________________________。
(5)从滤液中提取MnSO4.H2O晶体的操作是____________________________________。
(1)部分SO2与水结合生成H2SO3,H2SO3电离出H+使pH<2(2分)
(2)MnO2+2Fe2++4H+ Mn2++2Fe3++2H2O(2分) 得到的产品中含有FeSO4杂质(2分)
Mn2++2Fe3++2H2O(2分) 得到的产品中含有FeSO4杂质(2分)
(3)能(1分) Fe3+、Al3+水解生成的H+与Mn(OH)2反应,促进Fe3+、Al3+水解并最终转化为沉淀,且不引入新的杂质(2分)
(4)Fe(OH)3、Al(OH)3(1分) 用足量NaOH溶液溶解滤渣,过滤得到Fe(OH)3,再灼烧即得铁红(2分)
(5)蒸发浓缩、冷却结晶、过滤(2分)
(2)MnO2+2Fe2++4H+
 Mn2++2Fe3++2H2O(2分) 得到的产品中含有FeSO4杂质(2分)
Mn2++2Fe3++2H2O(2分) 得到的产品中含有FeSO4杂质(2分)(3)能(1分) Fe3+、Al3+水解生成的H+与Mn(OH)2反应,促进Fe3+、Al3+水解并最终转化为沉淀,且不引入新的杂质(2分)
(4)Fe(OH)3、Al(OH)3(1分) 用足量NaOH溶液溶解滤渣,过滤得到Fe(OH)3,再灼烧即得铁红(2分)
(5)蒸发浓缩、冷却结晶、过滤(2分)
试题分析:
(1)部分SO2与水结合生成H2SO3,H2SO3电离出H+使pH<2
(2)MnO2+2Fe2++4H+
 Mn2++2Fe3++2H2O; 得到的产品中含有FeSO4杂质
Mn2++2Fe3++2H2O; 得到的产品中含有FeSO4杂质(3)能; Fe3+、Al3+水解生成的H+与Mn(OH)2反应,促进Fe3+、Al3+水解并最终转化为沉淀,且不引入新的杂质
(4)Fe(OH)3、Al(OH)3; 用足量NaOH溶液溶解滤渣,过滤得到Fe(OH)3,再灼烧即得铁红;
(5)蒸发浓缩、冷却结晶、过滤

练习册系列答案
相关题目