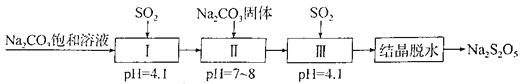
题目内容
【题目】(1)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的周期性变化。
①下表中的实线是元素周期表的部分边界。请在表中用实线补全周期表的边界_____________。

②元素甲是第三周期第VIA族元索,请在右边方框中按上图中氢元素的样式写出元素甲的原子序数、元素符号、元素名称和相对原子质量(取整数)________________。
③元素乙的M层电子数比K层电子数多1,则乙原子半径与甲原子半径比较: _______>________(用元素符号表示)。甲、乙的最高价氧化物对应的水化物的酸性强弱为_______>________(用化学式表示)。
④请写出55号元素在元素周期表中的位置:_______________________________
(2) 工业合成氨的反应N2(g)+ 3H2(g)![]() 2NH3(g)是一个可逆反应、反应条件是高温、 高压,并且需要合适的催化剂。已知形成1mol H一H键、1mol N一H键、Imol
2NH3(g)是一个可逆反应、反应条件是高温、 高压,并且需要合适的催化剂。已知形成1mol H一H键、1mol N一H键、Imol ![]() 键放出的能量分别为436kJ、391kJ、946kJ。
键放出的能量分别为436kJ、391kJ、946kJ。
①若1mol N2完全反应生成NH3可____________(填“吸收”或“放出”)热量_________ kJ。
②如果将1mol N2和3mol H2混合,在一定条件下使其充分反应,测得的热量数值总小于上述数值,
其原因是_______________________________________________________________
③实验室模拟工业合成氨时,在容积为2L的密闭容器中进行,反应经过10min后,生成10molNH3则用N2表示的化学反应速率是_______________![]() 。
。
【答案】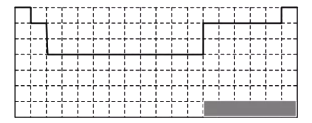
![]() Al S H2SO4 Al(OH)3 第六周期IA族 放出 92 该反应是可逆反应,1mol N2和3mol H2不能完全反应,因此放出的热量总是小于92kJ 0.25
Al S H2SO4 Al(OH)3 第六周期IA族 放出 92 该反应是可逆反应,1mol N2和3mol H2不能完全反应,因此放出的热量总是小于92kJ 0.25
【解析】
(1)①化学元素周期表是根据原子序数从小至大排序的化学元素列表,大致呈长方形,某些元素周期中留有空格,性质相近的元素在同一族中,如卤素、碱金属元素、稀有气体等;第一周期有2种元素,分别位于两端,第二周期有8种元素,靠左边2种,靠右边有6种元素,第三周期有8种元素,其分布与第二周期元素的分布一样,所以元素周期表的边界图为:

②元素甲是第三周期第VIA族元素,则甲为S元素,原子序数为16,元素名称为硫,相对原子质量为32,元素周期表中每一小格中中间的汉字为元素的名称,左上角的数字为原子序数,正下方的数字为相对原子质量,右上角的符号为元素符号,所以硫元素可表示为: ![]()
③元素乙的M层电子数比K层电子数多1,则为铝元素,同周期自左而右原子半径减小,所以硫S原子半径小于Al原子;同周期自左而右非金属性增强,最高价氧化物对应水化物的酸性增强,则酸性: H2SO4> Al(OH)3;
④稀有气体元素Xe (54号元素)位于元素周期表中第五周期零族,所以55号元素位于元素周期表第六周期IA族。
(2)①反应的化学方程式为N2(g)+ 3H2(g)![]() 2NH3(g),若1molN2与3molH2完全反应,生成2molNH3,需要断开1mol
2NH3(g),若1molN2与3molH2完全反应,生成2molNH3,需要断开1mol![]() 键和3molH-H键,需要吸收的能量为:946kJ +436kJ×3=2254kJ,生成2molNH3需形成6molN-H键,放出能量为:391kJ×6=2346kJ,所以总的结果是放出能量2346kJ-2254kJ=92kJ。
键和3molH-H键,需要吸收的能量为:946kJ +436kJ×3=2254kJ,生成2molNH3需形成6molN-H键,放出能量为:391kJ×6=2346kJ,所以总的结果是放出能量2346kJ-2254kJ=92kJ。
②由于该反应是可逆反应,1molN2与3molH2不可能完全反应,因此放出的能量总是小于92kJ。
③![]() c(NH3)= 10mol÷2L=5mol/L,
c(NH3)= 10mol÷2L=5mol/L,
v(NH3)=5mol/L÷10min=0.5mol/Lmin,
所以v(N2)= 0.5mol/Lmin ÷2=0.25 mol/Lmin。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案