题目内容
【题目】电化学原理在防止金属腐蚀、能量转换、物质制备等方面应用广泛。
(1)钢闸门在海水中易被腐蚀,常用以下两种方法减少其腐蚀:
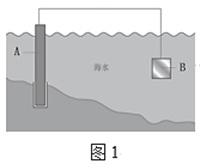
①图1中,A为钢闸门,材料B可以选择___(填字母序号)。
a.碳棒 b.铜板 c.锌板
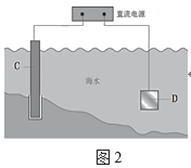
②图2中,钢闸门C做___极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D电极反应式为___,检验该电极反应产物的方法___。
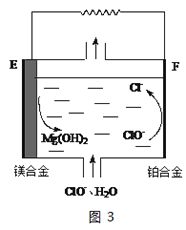
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的___极(填“正”或“负”)。F电极上的电极反应式为___。
(3)利用电化学法生产硫酸,可使绝大多数单质硫直接转化为SO3,在生产硫酸的同时还能化学发电。图4为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。
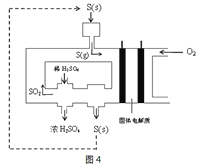
①正极每消耗4.48LO2(标准状况下),电路中转移电子的数目为___。
②S(g)在负极生成SO3的电极反应式为___。
【答案】c 阴 2Cl--2e-=Cl2↑ 将湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气 负 ClO- +2e-+H2O=Cl-+2OH- 0.8NA或4.816×1023 S-6e-+3O2-=SO3
【解析】
(1)①图1中,装置为原电池,A为钢闸门,要保护A,A应做正极,则材料B的金属性比A强。
②图2中,装置为电解池,要保护钢闸门C,C应不失电子。用氯化钠溶液模拟海水进行实验,D为石墨块,则D电极为阳极,溶液中的Cl-失电子生成Cl2,检验该电极反应产物应使用湿润的淀粉碘化钾试纸。
(2)E为镁合金,在该电极,镁失电子,F电极上ClO- 转化为Cl-。
(3)①正极O2+4e-=2O2-,由此可计算电路中转移电子的数目。
②在负极S(g)失电子转化为SO3。
(1)①图1中,装置为原电池,A为钢闸门,要保护A,A应做正极,则材料B应选择金属性比A强的锌。答案为:c;
②图2中,装置为电解池,要保护钢闸门C,C应做阴极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D电极为阳极,电极反应式为2Cl--2e-=Cl2↑,检验该电极反应产物的方法为将湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气。答案为:阴;2Cl--2e-=Cl2↑;将湿润的淀粉碘化钾试纸放在阳极附近,试纸变蓝,证明生成氯气;
(2)E为镁合金,做该燃料电池的负极。F电极为正极,电极反应式为ClO- +2e-+H2O=Cl-+2OH-。答案为:负;ClO- +2e-+H2O=Cl-+2OH-;
(3)①正极O2+4e-=2O2-,n(O2)=![]() =0.2mol,则电路中转移电子的数目为0.2mol×4NA= 0.8NA或4.816×1023。答案为:0.8NA或4.816×1023;
=0.2mol,则电路中转移电子的数目为0.2mol×4NA= 0.8NA或4.816×1023。答案为:0.8NA或4.816×1023;
②在负极S(g)在O2-存在的环境中失电子,转化为SO3,电极反应式为S-6e-+3O2-=SO3。答案为:S-6e-+3O2-=SO3。

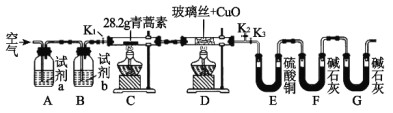
【题目】青蒿素是一种高效的抗疟药,某研究性学习小组的同学通过查阅资料获得如下信息:青蒿素是由碳、氢、氧三种元素所组成的,熔点为156~157℃,他们设计了如下装置来测量青蒿素的分子组成,回答下列问题:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
(1)试剂加入后首先要进行的操作是_____________,其目的是____________,实验中需要对开关K1、K2、K3进行操作,首次对开关K1、K2、K3进行操作的方法是________,适当时间后再关闭相应的开关,为提高实验的准确性,在C处停止加热后还应进行的操作是____________。
(2)试剂a、b分别是________________________________________,点燃C、D处酒精灯的先后顺序是___________________________,使用装置D的目的是___________。
(3)E中使用硫酸铜相对于使用CaCl2的好处(不考虑吸收效果的差异性)是_____。
(4)充分反应后获得的有关数据如上表(假设生成的气体全部被吸收):则测得青蒿素的最简式是_________________________。
(5)若要求出青蒿素的分子式,还需要通过实验测量出一个数据,请你指出该数据是什么,测量出该数据的方法是(只考虑理论上的可能性):___________。