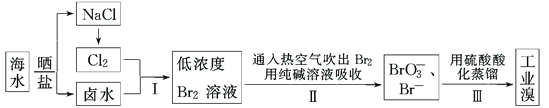
题目内容
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):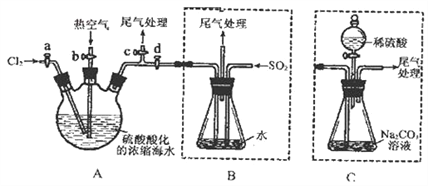
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)步骤②中鼓入热空气的作用为_____________________________;
(2)步骤③中发生的主要反应的离子方程式为______________________________。
(3)此实验中尾气可用______(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液
(4)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。
(5)与B装置相比,采用C装置的优点为____________。
【答案】 使A中生成的Br2 随空气流进入B中 Br2+SO2+2H2O=4H++2Br-+SO42- C 3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑ C装置的优点为操作简单、污染小
【解析】(1)热空气可以是将溴蒸汽吹出,额步骤②中鼓入热空气的作用为使A中生成的Br2 随空气流进入B中;(2)二氧化硫具有还原性,能被溴氧化,则步骤③中发生的主要反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-。(3)氯气等酸性气体可以用氢氧化钠溶液吸收,答案选C。(4)滴加稀硫酸之前,C中反应生成了NaBrO3等,这说明溴和碳酸钠溶液发生氧化还原反应,反应的化学方程式为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑。(5)尾气用水吸收效果差,因此根据装置构造可知与B装置相比,采用C装置的优点为操作简单、污染小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】周期表里的四种短周期主族元素的相对位置如下所示。已知它们的原子序数总和为38,用元素符号回答以下问题:
m | n | x | |
y |
(1)元素n的原子序数为________;
(2) m、n、x第一电离能的由小到大的顺序:电负性的由大到小的顺序:________。(用元素符号表示)
(3)m、x按照1:2所形成化合物的电子式: ________,分子构型:_____;
(4)用以上任意两种元素写出一个含有极性键的5原子非极性分子式:___