题目内容
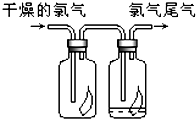 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是潮湿的有色布条褪色而干燥的有色布条不褪色
潮湿的有色布条褪色而干燥的有色布条不褪色
.(2)写出氯气与水反应的方程式式
H2O+Cl2═HClO+HCl
H2O+Cl2═HClO+HCl
.该反应中氧化剂与还原剂物质的量之比是1:1
1:1
.(3)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用氢氧化钠溶液吸收多余的氯气,原理是(用化学方程式表 示)
2NaOH+Cl2═NaClO+NaCl+H2O
2NaOH+Cl2═NaClO+NaCl+H2O
.根据这一原理,工业上常用廉价的石灰乳]吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是Ca(ClO)2
Ca(ClO)2
(填化学式).(4)氯气一旦泄漏,后果是非常严重的.当人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是
D
D
.A.NaOH B.NaCl C. KBr D. Na2CO3.
分析:(1)次氯酸能使有色布条褪色;
(2)氯气和水反应生成次氯酸、盐酸,该反应中氧化剂和还原剂都是氯气;
(3)氯水溶液呈酸性,所以可以用碱性溶液吸收多余的氯气,氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙和水;
(4)氯气和水反应生成盐酸和次氯酸,盐酸能和碱性物质反应,由于碱性物质与人体皮肤接触,所以不能用强碱性物质.
(2)氯气和水反应生成次氯酸、盐酸,该反应中氧化剂和还原剂都是氯气;
(3)氯水溶液呈酸性,所以可以用碱性溶液吸收多余的氯气,氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙和水;
(4)氯气和水反应生成盐酸和次氯酸,盐酸能和碱性物质反应,由于碱性物质与人体皮肤接触,所以不能用强碱性物质.
解答:解:(1)氯气没有漂白性,所以干燥的氯气不能使有色布条褪色,氯气和水反应生成盐酸和次氯酸,次氯酸有强氧化性而使有色布条褪色,所以看到的现象是A中有色布条不褪色,B中有色布条褪色,
故答案为:潮湿的有色布条褪色而干燥的有色布条不褪色;
(2)氯气和水反应生成次氯酸、盐酸,反应方程式为H2O+Cl2═HClO+HCl,该反应中氯元素化合价由0价变为+1价和-1价,所以氧化剂和还原剂都是氯气且物质的量之比为1:1,
故答案为:H2O+Cl2═HClO+HCl;1:1;
(3)氯水溶液呈酸性,所以可以用氢氧化钠溶液吸收多余的氯气,反应方程式为2NaOH+Cl2═NaClO+NaCl+H2O,氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙和水,漂白粉的有效成分是Ca(ClO)2,
故答案为:2NaOH+Cl2═NaClO+NaCl+H2O;Ca(ClO)2;
(4)氯气和水反应生成盐酸和次氯酸,盐酸能和碱性物质反应,由于碱性物质与人体皮肤接触,所以不能用强碱性物质,
A.NaOH具有强腐蚀性,故不选;
B.NaCl和氯气不反应,故不选;
C. KBr和氯气反应生成溴单质,溴也具有腐蚀性,故不选;
D. Na2CO3具有弱碱性且能和盐酸反应,故选;
故选D.
故答案为:潮湿的有色布条褪色而干燥的有色布条不褪色;
(2)氯气和水反应生成次氯酸、盐酸,反应方程式为H2O+Cl2═HClO+HCl,该反应中氯元素化合价由0价变为+1价和-1价,所以氧化剂和还原剂都是氯气且物质的量之比为1:1,
故答案为:H2O+Cl2═HClO+HCl;1:1;
(3)氯水溶液呈酸性,所以可以用氢氧化钠溶液吸收多余的氯气,反应方程式为2NaOH+Cl2═NaClO+NaCl+H2O,氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙和水,漂白粉的有效成分是Ca(ClO)2,
故答案为:2NaOH+Cl2═NaClO+NaCl+H2O;Ca(ClO)2;
(4)氯气和水反应生成盐酸和次氯酸,盐酸能和碱性物质反应,由于碱性物质与人体皮肤接触,所以不能用强碱性物质,
A.NaOH具有强腐蚀性,故不选;
B.NaCl和氯气不反应,故不选;
C. KBr和氯气反应生成溴单质,溴也具有腐蚀性,故不选;
D. Na2CO3具有弱碱性且能和盐酸反应,故选;
故选D.
点评:本题考查了次氯酸的漂白性、氯气的性质等知识点,明确次氯酸漂白性原理及氯气和碱反应原理是解本题关键,知道漂白粉有效成分和主要成分分别是什么.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是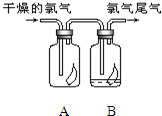 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是