题目内容
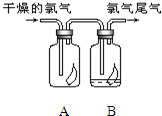 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,
可用
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是
A.O2 B.Cl2 C.CO2 D.HClO
(4)在(2)和(3)涉及到的反应中,属于氧化还原反应的是(填编号)
分析:(1)干燥的有色布条不褪色,而潮湿的褪色;氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性;
(2)利用氯气和氢氧化钠溶液反应来处理尾气;
(3)氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙和水;漂白粉的有效成分是Ca(ClO)2,漂白粉溶于水后,受空气中的CO2作用,生成碳酸钙和次氯酸;加稀盐酸后反应生成氯化钙、水和二氧化,产生的主要气体是二氧化碳;
(4)在(2)和(3)涉及到的反应分别为:2NaOH+Cl2=NaClO+NaCl+H2O;Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO;Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO,根据含元素化合价变化的反应为氧化还原反应,以此来解答.
(2)利用氯气和氢氧化钠溶液反应来处理尾气;
(3)氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙和水;漂白粉的有效成分是Ca(ClO)2,漂白粉溶于水后,受空气中的CO2作用,生成碳酸钙和次氯酸;加稀盐酸后反应生成氯化钙、水和二氧化,产生的主要气体是二氧化碳;
(4)在(2)和(3)涉及到的反应分别为:2NaOH+Cl2=NaClO+NaCl+H2O;Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO;Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO,根据含元素化合价变化的反应为氧化还原反应,以此来解答.
解答:解:(1)氯气无漂白性,干燥的有色布条无明显现象,氯气与水反应Cl2+H2O=HCl+HClO生成的次氯酸具有漂白性,所以可观察到潮湿有色布条的广口瓶的现象是有色布条褪色,设计实验A的目的是:干燥的氯气无漂白性,氯气和水反应生成的次氯酸具有漂白性,
故答案为:干燥的有色布条不褪色,而潮湿的褪色;干燥的氯气无漂白性,氯气和水反应生成的次氯酸具有漂白性;
(2)氯气与NaOH溶液发生反应为Cl2+2NaOH═NaCl+NaClO+H2O,其离子反应为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:NaOH;Cl2+2OH-═Cl-+ClO-+H2O;
(3)氯气和氢氧化钙反应2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,漂白粉的有效成分是Ca(ClO)2,次氯酸钙和二氧化碳反应Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO,生成的碳酸钙和盐酸反应生成二氧化碳,所以长期露置于空气中的漂白粉,加稀盐酸后CaCO3+2HCl═CaCl2+H2O+CO2↑,产生的气体是二氧化碳,故选C,
故答案为:Ca(ClO)2;Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO;C;
(4)Cl2+2NaOH=NaCl+NaClO+H2O中,Cl元素的化合价由0升高为+1价,由0降低为-1价,属于氧化还原反应,Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO;Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO反应前后各元素的化合价不变,不属于氧化还原反应,
故答案为:(2).
故答案为:干燥的有色布条不褪色,而潮湿的褪色;干燥的氯气无漂白性,氯气和水反应生成的次氯酸具有漂白性;
(2)氯气与NaOH溶液发生反应为Cl2+2NaOH═NaCl+NaClO+H2O,其离子反应为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:NaOH;Cl2+2OH-═Cl-+ClO-+H2O;
(3)氯气和氢氧化钙反应2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,漂白粉的有效成分是Ca(ClO)2,次氯酸钙和二氧化碳反应Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO,生成的碳酸钙和盐酸反应生成二氧化碳,所以长期露置于空气中的漂白粉,加稀盐酸后CaCO3+2HCl═CaCl2+H2O+CO2↑,产生的气体是二氧化碳,故选C,
故答案为:Ca(ClO)2;Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO;C;
(4)Cl2+2NaOH=NaCl+NaClO+H2O中,Cl元素的化合价由0升高为+1价,由0降低为-1价,属于氧化还原反应,Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO;Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO反应前后各元素的化合价不变,不属于氧化还原反应,
故答案为:(2).
点评:本题考查了氯气及其化合物性质的应用,明确具有漂白性的是次氯酸、掌握漂白粉的有效成分以及漂白原理是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是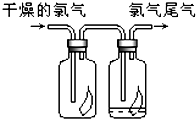 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是