题目内容
14.标准状况下有①6.72LCH4 ②3.01×1023个HCl ③13.6gH2S ④0.2molNH3,下列对四种气体的关系从小到大表示不正确的是( )| A. | 体积 ④<①<②<③ | B. | 密度 ①<④<③<② | ||
| C. | 质量 ④<①<③<② | D. | 氢原子数 ②<④<③<① |
分析 根据n=$\frac{V}{{V}_{m}}$计算6.72LCH4的物质的量,根据n=$\frac{N}{{N}_{A}}$计算HCl的物质的量,根据n=$\frac{m}{M}$计算13.6gH2S的物质的量.
A.相同条件下,气体体积之比等于其物质的量之比;
B.相同条件下,密度之比等于摩尔质量之比;
C.根据m=nM计算甲烷、HCl、氨气的质量进行判断;
D.根据各分子含有的H原子数目,计算各物质含有的H原子物质的量.
解答 解:①6.72LCH4的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,②3.01×1023个HCl的物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,③13.6gH2S的物质的量为$\frac{13.6g}{34g/mol}$=0.4mol,④0.2molNH3.
A.根据V=nVm知,相同条件下,气体体积之比等于其物质的量之比,故体积④<①<③<②,故A错误;
B.相同条件下,密度之比等于摩尔质量之比,故密度①<④<③<②,故B正确;
C.根据m=nM知,甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,氨气的质量为0.2mol×17g/mol=3.4g,故质量④<①<③<②,故C正确;
D.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目②<④<③<①,故D正确.
故选A.
点评 本题考查了阿伏伽德罗定律及其推论,明确物质的量的基本公式中各个物理量之间的关系是解本题关键,灵活运用基本公式分析解答即可,题目难度中等.

| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ------ |
(1)铝热反应是氧化还原反应,在反应中金属被氧化(填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为NaOH溶液,可观察到的实验现象为:有无色气体放出.
(3)实验室欲溶解此熔融物,下列试剂中最好的是B(填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
| A. | 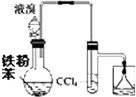 制溴苯并检验HBr | B. |  制乙炔 | ||
| C. | 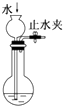 检查装置气密性 | D. |  比较醋酸、碳酸、苯酚酸性强弱 |
 完成下列各题:
完成下列各题:(1)已知下列反应的热化学方程式:
①6C (s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1;
②2H2(g)+O2 (g)=2H2O(g)△H2;
③C(s)+O2(g)═CO2(g)△H3.
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为12△H3+5△H2-2△H1.
(2)向体积为10L的恒容密闭容器中通入3mol X,在一定温度下发生如下反应:2X(g)?Y(g)+az(g),经5min后反应达到反应限度(即达到平衡状态).
①平衡时,测得容器内的压强为起始时的1.2倍,此时X的物质的量浓度为0.24mol•L-1,则方程式中a=3;用Y表示的反应速率为0.006mol•L-1•min-1.
②若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得容器内的反应速率如表所示:
| 容器 | 反应速率 | 容器 | 反应速率 |
| 甲 | v(X)=3.5mol•L-1•min-1 | 乙 | v(Y)=2 mol•L-1•min-1 |
| 丙 | v(Z)=4.5mol•L-1•min-1 | 丁 | v(X)=0.075mol•L-1•s-1 |
(3)高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.
①则阳极的电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O;
②若隔膜为阴离子交换膜,则OH-自左向右移动(填左、右):
③假设电解前后体积变化忽略不计,撤去隔膜混合后,与原溶液比较pH降低(升高、降低或不变)
| A. | 氢氧化钠与盐酸反应 OH-+H+=H2O | |
| B. | 用稀硫酸清除铁锈 Fe2O3+6H+=2Fe3++3H2O | |
| C. | 食盐水中滴加硝酸银溶液 Cl-+Ag+=AgCl↓ | |
| D. | 氢氧化钡跟硫酸铜溶液反应 Ba2++SO42-=BaSO4↓ |
 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
 A、B、C、D、E是中学常见的五种物质,其转化关系如图所示.其中某些物质可能已略去.已知D是单质,C、E是化合物.
A、B、C、D、E是中学常见的五种物质,其转化关系如图所示.其中某些物质可能已略去.已知D是单质,C、E是化合物. ;
;