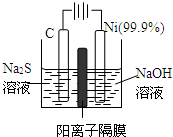
题目内容
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为
A.1:7 B.2:7 C.1:5 D.2:9
【答案】
A
【解析】设生成的NO2、N2O4、、NO的物质的量(mol)分别是1、1、1。则反应中转移电子共计是6mol。在反应中FeS失去9个电子,所以根据电子的得失守恒可知,FeS是2/3mol,则生成Fe2(SO4)3是2/9mol,所以根据铁原子守恒可知,生成硝酸铁是2/9mol。所以参加反应的硝酸是2/9×3+1+1×2+1=42/9mol,则实际参加反应的FeS与HNO3的物质的量之比为1:7,答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
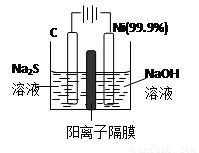
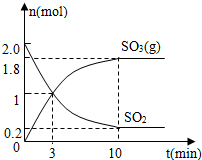 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题: