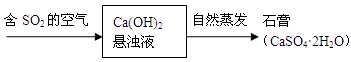
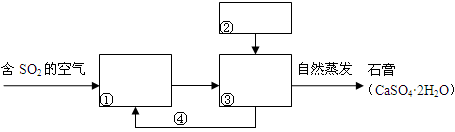
��Ŀ����
���仯��������Ȼ���й㷺���ڣ��������
ԭ���ش��������⣺
��1����ͼ��ʾһ���¶��£������Ϊ10L���ܱ������г���1molO2��һ������SO2��SO2��SO3(g)��Ũ����ʱ��仯�������
�ٸ��¶��£��ӷ�Ӧ��ʼ��ƽ��ʱ������ƽ����Ӧ������ ��
�ڸ��¶��£���Ӧ2SO2(g)+O2(g) 2SO3(g)��ƽ�ⳣ��Ϊ ��
��2���Ի�ͭ����Ҫ�ɷ�CuFeS2��Ϊԭ�ϣ������ա�������ʹ��Ԫ�ؼ������й����ʽ���¯������ͭԪ�ػ�ԭΪͭ����������Ҫ��ӦΪ��
2Cu2S(s)+3O2(g) = 2Cu2O(s)+2SO2(g) ��H =-768.2 kJ��mol��1
2Cu2O(s)+ Cu2S (s) = 6Cu(s)+SO2(g) ��H =+116.0 kJ��mol��1
�١����ա�ʱ��ͨ����������ʹ��ͭ���������ɱ�ɰ����Ҫ�ɷ���Cu2S��FeS�������ʵ�����Ϊ1:2����SO2���÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
���������У�Cu2S������ʵ�����O2��Ӧ����Cu���Ȼ�ѧ����ʽΪ�� ��
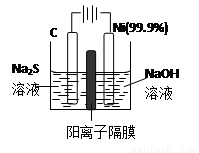
��3���õ��ķ�����������Һ����Ϊ��������о�������Ҫ��ʵ�����壬������ת��Ϊ�������ǵ�ⷨ�������������һ����Ҫ���ݡ�
��ͼ���ǵ������������ʵ��װ�ã�
����֪�����ķ�ӦΪ��(x+1)S2��=SxS2��+2xe�����������ĵ缫��Ӧʽ�ǣ� ��
����Ӧת��xmol����ʱ���������������Ϊ ����״���£���
�ڽ�Na2S��9H2O����ˮ������������Һʱ��ͨ�����ڵ����������ܽ⡣��ԭ���ǣ������ӷ�Ӧ����ʽ��ʾ���� ��
��14�֣�ÿ��2�֣�
��1����9��10-3mol•L‾1•min‾1 ��8.1��103 L•mol‾1
��2����2CuFeS2 + O2 Cu2S
+ 2FeS + SO2
Cu2S
+ 2FeS + SO2
��Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) ��H =-217.4 kJ��mol-1
��3����2H2O+2e��=2OH��+H2��11.2x L
��2S2����O2��2H2O=2S����4OH�� ��
��������
���������
��1���ٸ������ʼ��㹫ʽ�������������Ϊ9��10-3mol•L‾1•min‾1 �� �� K=C2(SO3)/C2(SO2)*C(O2)= 8.1��103 L•mol‾1;
��2���ٸ�����Ŀ��Ϣ�����ա�ʱ��ͨ����������ʹ��ͭ���������ɱ�ɰ����Ҫ�ɷ���Cu2S��FeS�������ʵ�����Ϊ1:2����SO2������ȷ������Ӧ��ΪCuFeS2 + O2����Ӧ����Cu2S + 2FeS + SO2 ��Ҫ����2��1��Ȼ���ԭ���غ����á�
��Ҫ����2��1��Ȼ���ԭ���غ����á�
��Cu2S������ʵ�����O2��Ӧ����Cu����Ȼ���Ǹ�������ԭ��Ӧ�����ݻ��ϼ������н���˹���ɿ��Եó��Ȼ�ѧ����ʽΪCu2S(s) + O2(g) = 2Cu(s) + SO2(g) ��H =-217.4 kJ��mol-1��
��3����������Һ�е��������õ��ӵ�����ֻ������������������ֻ��Na+��H+,����ֻ����H+�õ��ӣ����ǵ��Ǽ��Ե������Һ�����Է�ӦʽΪ2H2O+2e��=2OH��+H2�����ݵ����غ㣬���е���Ӧת��xmol����ʱ���������������ʵ���Ϊx/2mol�����������Ϊ11.2x L��������S2-��ǿ�Ļ�ԭ���ױ������������������ٿ��ǵ�������Һ�ʼ��ԣ����������ӷ���ʽΪ2S2����O2��2H2O=2S����4OH�� ��
���㣺���鷴Ӧ���ʺ�ƽ�ⳣ���ļ��㣬���龰�·���ʽ����д�͵缫��Ӧ����ʽ����д�����ݡ�

 ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д� ���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺
���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺

 2SO3��g���������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺
2SO3��g���������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺

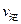 ���>������<����=����
���>������<����=���� ��
��