题目内容
 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:(1)如图表示一定温度下,向体积为10L的密闭容器中充入1molO2和一定量的SO2后,SO2和SO3(g)的浓度随时间变化的情况.
①该温度下,从反应开始至平衡时氧气的平均反应速率是
②该温度下,反应2SO2(g)+O2(g)?2SO3(g)的平衡常数为
(2)以黄铜矿(主要成分CuFeS2)为原料,经焙烧、熔炼等使铁元素及其他有关杂进入炉渣,将铜元素还原为铜.发生的主要反应为:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ?mol-1
2Cu2O(s)+Cu2S (s)═6Cu(s)+SO2(g)△H=+116.0kJ?mol-1
①“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS,其物质的量比为1:2)和SO2,该反应的化学方程式为:
②在熔炼中,Cu2S与等物质的量的O2反应生成Cu的热化学方程式为:

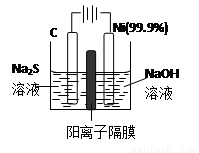
(3)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容.如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-═SxS2-+2xe-,则阴极的电极反应式是:
②将Na2S?9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解.其原因是(用离子反应方程式表示):
分析:(1)①根据v=
来计算化学反应速率;
②根据化学反应的三行式计算化学平衡常数;
(2)①根据信息确定化学反应的反应物和生成物,进而书写化学方程式;
②利用盖斯定律来计算化学反应的焓变;
(3)①根据电解池的工作原理:阴极上发生得电子的还原反应,阳极上发生失去电子的氧化反应来回答;
②硫离子具有强的还原性,易被氧气氧化为硫单质,据此来回答.
| △c |
| △t |
②根据化学反应的三行式计算化学平衡常数;
(2)①根据信息确定化学反应的反应物和生成物,进而书写化学方程式;
②利用盖斯定律来计算化学反应的焓变;
(3)①根据电解池的工作原理:阴极上发生得电子的还原反应,阳极上发生失去电子的氧化反应来回答;
②硫离子具有强的还原性,易被氧气氧化为硫单质,据此来回答.
解答:解:(1)①开始至平衡时二氧化硫的平均反应速率是v=
=
=1.8×10-2mol?L?1?min?1,化学反应速率之比等于方程式的系数之比,所以开始至平衡时氧气的平均反应速率是v=9×10-3mol?L?1?min?1,故答案为:9×10-3mol?L?1?min?1;
②根据图示内容知道:2SO2(g)+O2(g)?2SO3(g)
初始浓度:0.2 0.1 0
变化浓度:0.18 0.09 0.18
平衡浓度:0.02 0.01 0.18
则K=
=
=8.1×103L?mol?1,
故答案为:8.1×103 L?mol?1;
(2)①根据信息:“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS,其物质的量比为1:2)和SO2,知道反应物是黄铜矿和氧气,产物是
Cu2S和FeS,其物质的量比为1:2,即方程式为:2CuFeS2+O2
Cu2S+2FeS+SO2,故答案为:2CuFeS2+O2
Cu2S+2FeS+SO2;
②已知:A、2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ?mol-1,B、2Cu2O(s)+Cu2S (s)═6Cu(s)+SO2(g)△H=+116.0kJ?mol-1
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g)可以是
(A+B),即△H=
×(116.0kJ?mol-1-768.2kJ?mol-1)=-217.4 kJ?mol-1,
故答案为:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.4 kJ?mol-1;
(3)①阴极上是阳离子氢离子发生得电子的还原反应,即2H++2e-=H2↑,当反应转移xmol电子时,产生的气体0.5xmol,体积为0.5xmol×22.4L/mol=11.2xL,
故答案为:2H++2e-=H2↑;11.2xL;
②硫化钠中的硫离子具有强的还原性,易被氧气氧化为硫单质,配制时要隔绝氧气,可用氮气气流,即:2S2-+O2+2H2O=2S↓+4OH-,故答案为:2S2-+O2+2H2O=2S↓+4OH-.
| △c |
| △t |
| ||
| 10min |
②根据图示内容知道:2SO2(g)+O2(g)?2SO3(g)
初始浓度:0.2 0.1 0
变化浓度:0.18 0.09 0.18
平衡浓度:0.02 0.01 0.18
则K=
| c2(SO3) |
| c2(SO2)?c(O2) |
| 0.182 |
| 0.022×0.01 |
故答案为:8.1×103 L?mol?1;
(2)①根据信息:“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS,其物质的量比为1:2)和SO2,知道反应物是黄铜矿和氧气,产物是
Cu2S和FeS,其物质的量比为1:2,即方程式为:2CuFeS2+O2
| ||
| ||
②已知:A、2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ?mol-1,B、2Cu2O(s)+Cu2S (s)═6Cu(s)+SO2(g)△H=+116.0kJ?mol-1
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g)可以是
| 1 |
| 3 |
| 1 |
| 3 |
故答案为:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.4 kJ?mol-1;
(3)①阴极上是阳离子氢离子发生得电子的还原反应,即2H++2e-=H2↑,当反应转移xmol电子时,产生的气体0.5xmol,体积为0.5xmol×22.4L/mol=11.2xL,
故答案为:2H++2e-=H2↑;11.2xL;
②硫化钠中的硫离子具有强的还原性,易被氧气氧化为硫单质,配制时要隔绝氧气,可用氮气气流,即:2S2-+O2+2H2O=2S↓+4OH-,故答案为:2S2-+O2+2H2O=2S↓+4OH-.
点评:本题综合考查学生热化学、电化学、化学反应速率和平衡等方面的知识,注意知识的归纳和整理是解题关键,难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目

 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

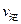 (填“>”、“<”或“=”)
(填“>”、“<”或“=”) )
)