题目内容
【题目】过氧化氢(H2O2)俗称双氧水。是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业。回答下列问题:
(1) H2O2的电子式为_______________。
(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜。
已知:Cu(s)+2H+ (aq)==Cu2+(aq) + H2(g) H= +64 kJ/mol
2H2O2(1) ==2H2O(l)+O2(g) H =-196 kJmol
H2(g) + l/2O2(g) ==H2O(l) H =-286 kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:__________________。
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4![]() (NH4)2S2O8+ H2↑,然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:
(NH4)2S2O8+ H2↑,然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:
①电解时阳极的电极反应式为___________________;
②(NH4)2 S2O8水解时发生反应的化学方程式为 ____________________。
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方案。
实验编号 | 温度 | 催化剂 | 浓度 |
甲组实验I | 25℃ | 三氧化二铁 | 10mL 5% H2O2 |
甲组实验II | 25℃ | 二氧化锰 | 10 mL 5% H2O2 |
甲、乙两小组得出如下图数据。
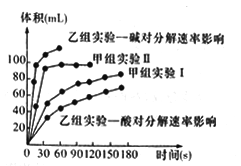
①甲小组实验得出的结论是______________________。
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在________(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为_______________;支持这一方案的理由是_______________________。
③已知过氧化氢还是一种极弱的二元酸:H2O2![]() H++HO2-(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-
H++HO2-(Ka1=2.4×10-12)。当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-![]() HO2-+H2O,该反应中,正反应速率为V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为_________(保留3位有效数字)。
HO2-+H2O,该反应中,正反应速率为V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为_________(保留3位有效数字)。
【答案】 ![]() Cu(s)+H2O2(1)+2H- (aq)═Cu2-(aq)+2H2O(l) H=-320 kJ/mol 2HSO4--2e-═S2O82-+2H-或 2SO42--2e-═S2O82- (NH4)2S2O6+2H2O═2NH4HSO4+H2O2 H2O2分解时,MnO2比Fe2O3催化效率更高 碱 BaO2+2H-+SO42-═BaSO4+H2O2 (BaSO4的生成有利于平衡右移即有利于H2O2的生成)酸性环境有利于H2O2的存在(等其他合理原因) 1.33×104
Cu(s)+H2O2(1)+2H- (aq)═Cu2-(aq)+2H2O(l) H=-320 kJ/mol 2HSO4--2e-═S2O82-+2H-或 2SO42--2e-═S2O82- (NH4)2S2O6+2H2O═2NH4HSO4+H2O2 H2O2分解时,MnO2比Fe2O3催化效率更高 碱 BaO2+2H-+SO42-═BaSO4+H2O2 (BaSO4的生成有利于平衡右移即有利于H2O2的生成)酸性环境有利于H2O2的存在(等其他合理原因) 1.33×104
【解析】(1) H2O2的电子式为![]() ;
;
(2)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H1=+64kJ/mol
②2H2O2(l)=2H2O(l)+O2(g)△H2=-196kJ/mol
③H2(g)+![]() O2(g)=H2O(l)△H3=-286kJ/mol
O2(g)=H2O(l)△H3=-286kJ/mol
根据盖斯定律①+![]() ×②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=△H1+
×②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=△H1+![]() ×△H2+△H3=-320kJ/mol;(3)然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:①根据总反应式2NH4HSO4
×△H2+△H3=-320kJ/mol;(3)然后由(NH4)2 S2O8水解得到H2O2和另一产物。则:①根据总反应式2NH4HSO4![]() (NH4)2S2O8+ H2↑可知,电解时阳极HSO4-失电子产生S2O82-,其电极反应式为:2HSO4--2e-═S2O82-+2H-或 2SO42--2e-═S2O82-;②(NH4)2S2O8水解生成NH4HSO4,发生反应的化学方程式为:(NH4)2S2O6+2H2O═2NH4HSO4+H2O2;(4)①甲组实验Ⅱ比Ⅰ所用的过氧化氢的浓度大,根据图像判断Ⅱ反应速度要快于Ⅰ。所以Ⅰ以得出结论:浓度越大,H2O2分解速率越快;②根据乙组的图像可知:相同条件下,H2O2在碱性环境下放出气体速率较快;根据题意可知:反应物为Ba02固体与硫酸溶液,生成物H202。根据质量守恒定律可知所以另一种生成物为钡和硫酸根形成的硫酸钡,化学反应方程式为BaO2 +H2SO4= BaSO4 ↓+H2O2;该方案反应物中有硫酸铜,可形成酸性反应环境,结合过氧化氢在酸性环境下分解较慢这一事实可判断该方案成立;③根据反应H2O2
(NH4)2S2O8+ H2↑可知,电解时阳极HSO4-失电子产生S2O82-,其电极反应式为:2HSO4--2e-═S2O82-+2H-或 2SO42--2e-═S2O82-;②(NH4)2S2O8水解生成NH4HSO4,发生反应的化学方程式为:(NH4)2S2O6+2H2O═2NH4HSO4+H2O2;(4)①甲组实验Ⅱ比Ⅰ所用的过氧化氢的浓度大,根据图像判断Ⅱ反应速度要快于Ⅰ。所以Ⅰ以得出结论:浓度越大,H2O2分解速率越快;②根据乙组的图像可知:相同条件下,H2O2在碱性环境下放出气体速率较快;根据题意可知:反应物为Ba02固体与硫酸溶液,生成物H202。根据质量守恒定律可知所以另一种生成物为钡和硫酸根形成的硫酸钡,化学反应方程式为BaO2 +H2SO4= BaSO4 ↓+H2O2;该方案反应物中有硫酸铜,可形成酸性反应环境,结合过氧化氢在酸性环境下分解较慢这一事实可判断该方案成立;③根据反应H2O2![]() H++HO2-,有Ka1=
H++HO2-,有Ka1= =2.4×10-12,反应达平衡时,V正=v逆,V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-)= k正c(H2O2) c(OH- ),则
=2.4×10-12,反应达平衡时,V正=v逆,V正=k正c(H2O2) c(OH- ),逆反应速率为v逆=k逆c(H2O) c(HO2-)= k正c(H2O2) c(OH- ),则![]() =
= =
=![]() =
=![]() =
=![]() =2.4×102。
=2.4×102。

 阅读快车系列答案
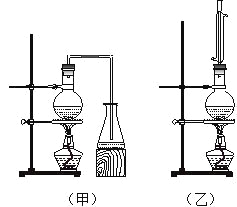
阅读快车系列答案【题目】实验室制取乙酸丁酯的实验装置有如右下图所示两种装置供选用。其有关物质的物理性质
如下表:
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用_______(填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是___________(选填答案编号)。
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。
