题目内容
18.①标准状况下22.4L CH4 ②1.5mol NH3 ③1.806x1024个H2O④标准状况下73g HCl所含H原子个数由多到少的顺序为③>②>①>④(填序号);在含0.4mol Al2(SO4)3的溶液中SO42-的物质的量为0.6mol.分析 根据n=$\frac{V}{Vm}$计算甲烷物质的量,根据n $\frac{N}{{N}_{A}}$计算水的物质的量,根据n=$\frac{m}{M}$计算式HCl的物质的量,结合分子式计算含有H原子物质的量,根据 Al2(SO4)3的分子构成确定溶液中SO42-的物质的量.
解答 解:①标准状况下,22.4L CH4的物质的量为 $\frac{22.4L}{22.4L/mol}$=1mol,含有H原子为1mol×4=4mol;
②1.5mol NH3含有H原子为1.5mol×3=4.5mol;
③1.806×1024个H2O的物质的量为$\frac{1.806×1{0}^{24}}{6.02×1{0}^{23}}$=3mol,含有H原子为3mol×2=6mol;
④标准状况下,73g HCl的物质的量为$\frac{73g}{36.5g/mol}$=2mol,含有H原子为2mol×1=2mol,
所含H原子个数由多到少的顺序是:③>②>①>④,在含0.4mol Al2(SO4)3的溶液中,SO42-的物质的量为铝离子物质的量的1.5倍,所以SO42-的物质的量为0.6mol,
故答案为:③>②>①>④;0.6mol.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心计算,注意对化学式意义的理解.

练习册系列答案
相关题目
8.如表实验现象所对应的离子方程式正确的是( )
| 实验 | 现象 | 离子方程式 | |
| A | 稀硫酸滴入含酚酞的Ba(OH)2溶液中 | 白色沉淀生成,溶液由红色变无色 | Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O |
| B | 磁性氧化铁(Fe3O4)溶于氢碘酸 | 磁性氧化铁溶解,溶液变棕黄色 | Fe3O4+8H+═Fe2++2Fe3++4H2O |
| C | Ca(OH)2澄清溶液加到氯水中 | 溶液由黄绿色变为无色 | Cl2+2Ca(OH)2═Cl-+ClO-+Ca2++H2O |
| D | 稀硫酸加到KI淀粉溶液中 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| A. | A | B. | B | C. | C | D. | D |
9.北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
1KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3 稀溶液,将I2 还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(3)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;
②b中反应所产生的I2的物质的量是1.0×10-5mol.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
1KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3 稀溶液,将I2 还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(3)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;
②b中反应所产生的I2的物质的量是1.0×10-5mol.
6.下列说法中正确的是( )
| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 阿伏加德罗常数是12 kg 12C中含有的碳原子数 | |
| C. | 1 molH2O分子中含有10 mol电子 | |
| D. | 一个NO分子的质量是a g,一个NO2分子的质量是b g,则氧原子的摩尔质量是(b-a)g•mol-1 |
13.下列关于混合物、纯净物、电解质和非电解质的正确组合是( )
| 净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 冰醋酸 | 漂白粉 | 硫酸钡 | 二氧化硫 |
| C | 石墨 | 空气 | 苛性钾 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
10.关于化学反应的说法中错误的是( )
| A. | 如图所示的反应为放热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 化学反应具有方向性 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
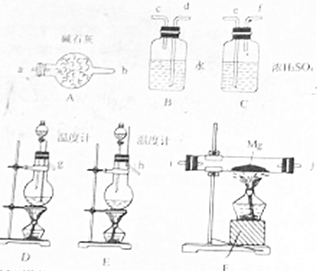 用以下反应制取氮气:NaNO2+NH4Cl$\underset{\stackrel{65℃}{=}}{△}$NaCl+N2↑+2H20,已知氮化镁易与水反应,Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓在设计装置时必须考虑这一点:
用以下反应制取氮气:NaNO2+NH4Cl$\underset{\stackrel{65℃}{=}}{△}$NaCl+N2↑+2H20,已知氮化镁易与水反应,Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓在设计装置时必须考虑这一点: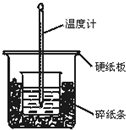 通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题: