题目内容
7.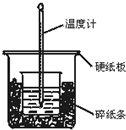 通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如果不盖硬纸板,求得的中和热数值偏小(填“偏大”,“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热相等(填“相等”“不相等”),简述理由:因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱的用量无关.
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g•℃),三次平行操作测得终止温度与起始温度差(t2-t1)分别为:
①3.2℃②2.2℃③3.0℃
写出表示盐酸与NaOH溶液反应的中和热的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-51.8kJ/mol.(小数点后保留一位小数)
分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)不盖硬纸板,会有一部分热量散失;
(3)根据中和热的概念和实质来回答;
(4)先判断温度差的有效性,然后求出温度差平均值;再根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热.
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:相等;因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关;
(4)三次平行操作测得终止温度与起始温度差(t2-t1)分别为:①3.2℃②2.2℃③3.0℃,第②组舍去,温度差的平均值为3.1℃,50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行中和反应生成水的物质的量为0.05L×0.5mol/L×2=0.025mol,溶液的质量为100ml×1g/ml=100g,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.1℃=1259.8J,即1.2598kJ,所以实验测得的中和热△H=-$\frac{1.2598kJ}{0.025mol}$=-51.8kJ/mol,该反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-51.8 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-51.8 kJ/mol.
点评 本题考查中和热的测定与计算,题目难度中等,注意理解中和热的概念是解题的关键.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案 已知:1mol C-H键完全断裂时吸收热量412kJ,1mol C-C键完全断裂时吸收热量348kJ1mol C=C键完全断裂吸收热量612kJ,1mol H-H键完全断裂时吸收热量436kJ.上述反应的△H等于( ) kJ•mol-1.
已知:1mol C-H键完全断裂时吸收热量412kJ,1mol C-C键完全断裂时吸收热量348kJ1mol C=C键完全断裂吸收热量612kJ,1mol H-H键完全断裂时吸收热量436kJ.上述反应的△H等于( ) kJ•mol-1.| A. | -124 | B. | +124 | C. | -288 | D. | +288 |
| A. | 非金属氧化物 酸性氧化物 | B. | 化合物 非电解质 | ||
| C. | 溶液 胶体 | D. | 悬浊液 分散系 |

| A. | 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色 | |
| C. | 图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大 | |
| D. | 图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀 |
| A. | 每消耗1molH2(g)释放483.6kJ的能量 | |
| B. | 每生成1molH2O(g)释放483.6kJ的能量 | |
| C. | 方程式中H2(g)计量数改变△H值不变 | |
| D. | 同条件下2molH2O(g)完全分解吸收的能量为483.6kJ |
 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)