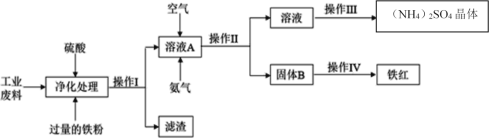
题目内容
【题目】超细氧化铝是一种重要的功能陶瓷原料。
Ⅰ、(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为________________________________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程中须称量NH4Al(SO4)2·12H2O固体_________g;
(3)在0.1 mol·L-1 NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见如图:
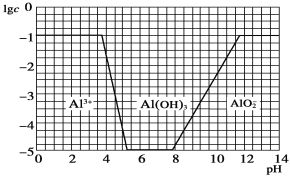
用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有_______________________、_______________________。
Ⅱ、从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程:
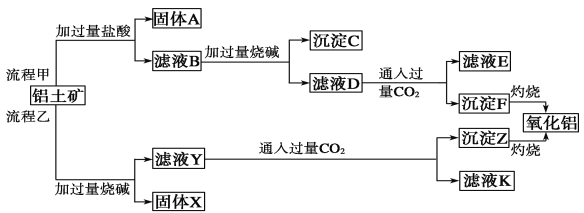
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_________________________。
(2)流程乙向滤液Y中通入足量CO2的离子方程式为_____________________。
(3)滤液E、K中溶质的主要成分是__________(填化学式)。
【答案】2NH4AlO(OH)HCO3![]() Al2O3+2NH3↑+3H2O+2CO2↑ 4.5 NH4++OH-=NH3·H2O Al3++3OH-=Al(OH)3↓ Al2O3+6H+=2Al3++3H2O CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- NaHCO3
Al2O3+2NH3↑+3H2O+2CO2↑ 4.5 NH4++OH-=NH3·H2O Al3++3OH-=Al(OH)3↓ Al2O3+6H+=2Al3++3H2O CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- NaHCO3
【解析】
Ⅰ、(1)根据原子守恒可知NH4AlO(OH)HCO3热分解的化学反应方程式为2NH4AlO(OH)HCO3![]() Al2O3+2NH3↑+3H2O+2CO2↑;
Al2O3+2NH3↑+3H2O+2CO2↑;
(2)由物质的量浓度的定义式可知m[NH4Al(SO4)212H2O]=nM=cVM=0.1mol/L×0.1L×453g/mol=4.53g,由于托盘天平的精确度为0.1g,故为4.5g;
(3)由图象可知,开始阶段c(Al3+)没变化,是由于OH-跟H+反应;而后c(Al3+)降低,生成Al(OH)3沉淀,是由于OH-跟Al3+反应;Al3+完全沉淀后,调节pH至7,OH-跟NH4+反应,发生的化学反应方程式为:NH4++OH-=NH3·H2O、Al3++3OH-=Al(OH)3↓;
Ⅱ、(1)流程甲加入盐酸,Al2O3与稀盐酸反应,离子方程式为:Al2O3+6H+=2Al3++3H2O;
(2)流程乙中滤液Y为偏铝酸钠溶液,向其中通入足量CO2,化学反应方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,离子方程式:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(3)滤液Y和D为偏铝酸钠溶液,通入过量的二氧化碳反应的化学方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,因此滤液E、K中溶质的主要成分是NaHCO3。

 阅读快车系列答案
阅读快车系列答案【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A. 实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K= 1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
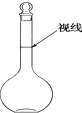
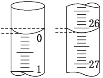
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_______mL,终点读数为_______mL,所用盐酸溶液的体积为_______mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度__________________________。