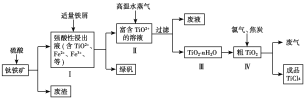
题目内容
【题目】已知A、B为单质,C为化合物,能实现上述转化关系的是( )
![]()
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.①③
C.②④ D.③④
【答案】
【解析】选C。①若A是Na,B是O2,则C是Na2O2,C的水溶液是NaOH,电解NaOH溶液得到氢气和氧气,错误;②若C溶液遇Na2CO3放出CO2气体,则C可能是HCl、HBr、HI等,电解HCl、HBr、HI等的水溶液就是电解电解质本身,在阴极产生氢气,在阳极产生Cl2、Br2、I2,因此A可能是H2,正确;③若C溶液中滴加KSCN溶液显红色,则C中含有Fe3+,电解铁盐不可能产生金属Fe,错误;④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则C中含有Cu2+,该盐可能是CuCl2、CuBr2溶液,电解CuCl2、CuBr2溶液会产生Cu和Cl2、Br2,因此B可能为Cu ,正确。

练习册系列答案
相关题目