题目内容
【题目】TiO2在工业生产和日常生活中有重要用途。
工业上用钛铁矿(主要成分是TiO2、少量FeO和Fe2O3)制备TiO2,再用TiO2制备TiCl4等产品的一种工艺流程如图所示:
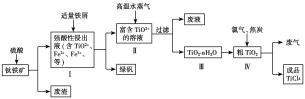
已知:TiO2+发生水解反应的化学方程式为TiO2++(n+1)H2O![]() TiO2·nH2O+2H+。
TiO2·nH2O+2H+。
(1)硫酸与TiO2反应的离子方程式是_________________________。
(2)由TiO2制取TiCl4时涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH1=-72 kJ·mol-1;
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)
ΔH2=+38.8 kJ·mol-1;
C(s)+CO2(g)===2CO(g)
ΔH3=+282.8 kJ·mol-1。
①反应C(s)+CO2(g)===2CO(g)在高温下能够自发进行的原因是____________________。
②反应C(s)+O2(g)===CO2(g)的ΔH=________。
(3)向Ⅰ中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:2Fe3++Fe===3Fe2+;2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O;Ti3+(紫色)+Fe3++H2O===TiO2+(无色)+Fe2++2H+。
①结合信息判断Fe3+、TiO2+、Fe2+的氧化性强弱关系:________>________>________。
②加入铁屑的作用是_____________________。
(4)向Ⅱ中不断通入高温水蒸气,维持溶液沸腾一段时间,析出水合二氧化钛沉淀。请用化学平衡理论分析通入高温水蒸气的作用:_________________________。
(5)依据绿色化学理念,该工艺流程中存在的不足之处是_________________________(写出一条即可)。
(6)工业上可通过电解TiO2来获得Ti(同时产生O2):处理过的TiO2为阴极,石墨为阳极,熔融CaCl2为电解液,电解槽中加入炭块。阴极反应式为_____________________;
电解过程中需定期向电解槽中加入炭块的原因是______________________。
【答案】
【解析】(1)根据Ⅰ中溶液的成分,钛元素以TiO2+的形式存在,故硫酸与TiO2反应生成TiO2+,离子方程式为TiO2+2H+===TiO2++H2O。(2)根据ΔG=ΔH-TΔS,ΔH>0,高温下能够自发进行的原因是该反应为熵增反应。将给出的3个反应标为a、b、c,根据盖斯定律由a-b-c可得C(s)+O2(g)===CO2(g)的ΔH=-393.6 kJ·mol-1。(3)①氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,由第2个式子知氧化性TiO2+>Fe2+,由第3个式子知Fe3+>TiO2+,则有Fe3+>TiO2+>Fe2+。②向Ⅰ中加入铁屑至浸出液显紫色,根据离子的颜色可知溶液中含有Ti3+,由第3个式子可知Fe3+能将Ti3+氧化为TiO2+,故加入铁屑作还原剂,将Fe3+还原为Fe2+,保护Fe2+不被氧化。(4)水解反应是吸热反应,通入高温水蒸气使体系的温度升高,促进TiO2+的水解,溶液被稀释,H+浓度降低,平衡正向移动,也促进TiO2+的水解。(5)根据工艺流程可看出生产过程中产生了废气、废液、废渣,对环境有污染,不符合绿色化学思想。(6)熔融CaCl2为电解液,处理过的TiO2为阴极,TiO2得电子生成Ti;阳极反应式为2O2--4e-===O2↑,石墨为阳极,碳单质与阳极产生的氧气反应而不断减少,需定期向电解槽中加入炭块。

 阅读快车系列答案
阅读快车系列答案