题目内容
14.如图是用明矾[KAl(SO4)2•12H2O]制取硫酸铝和硫酸钾的操作步骤流程图(图中略去了沉淀物的洗涤操作),请在图中圆括号内填入适当的试剂名称,在方括号内填入适当的分离方法,并回答有关问题.
(1)试剂a是氨水,b是稀硫酸,c是KOH溶液.
(2)分离方法①是过滤,②是加热,③是蒸发结晶.
(3)进行上述操作要用到的玻璃仪器有漏斗、烧杯、玻璃棒、酒精灯、蒸发皿、试管.
分析 明矾是[KAl(SO4)2•12H2O,将明矾溶于水得到明矾溶液,向明矾溶液中加入过量氨水得到Al(OH)3,Al(OH)3溶于稀硫酸得到A为Al2(SO4)3溶液,将Al2(SO4)3溶液蒸干得到Al2(SO4)3晶体,所以进行操作①时,加入的试剂a是氨水;分离难溶性固体和溶液采用过滤方法,所以操作①是过滤,试剂b为稀硫酸,操作③为蒸发结晶,B中溶质成分是K2SO4、(NH4)2SO4,向溶液中加入KOH溶液并加热得到K2SO4、NH3,所以试剂c为KOH溶液,要使氨气从溶液中充分挥发,则操作②为加热,氨气溶于水得氨水,C中成分是K2SO4和过量的KOH,C中加入稀硫酸得K2SO4溶液,蒸发结晶得到K2SO4晶体,符合题中各物质的转化关系,据此分析解答.
解答 解:明矾是[KAl(SO4)2•12H2O,将明矾溶于水得到明矾溶液,向明矾溶液中加入过量氨水得到Al(OH)3,Al(OH)3溶于稀硫酸得到A为Al2(SO4)3溶液,将Al2(SO4)3溶液蒸干得到Al2(SO4)3晶体,所以进行操作①时,加入的试剂a是氨水;分离难溶性固体和溶液采用过滤方法,所以操作①是过滤,试剂b为稀硫酸,操作③为蒸发结晶,B中溶质成分是K2SO4、(NH4)2SO4,向溶液中加入KOH溶液并加热得到K2SO4、NH3,所以试剂c为KOH溶液,要使氨气从溶液中充分挥发,则操作②为加热,氨气溶于水得氨水,C中成分是K2SO4和过量的KOH,C中加入稀硫酸得K2SO4溶液,蒸发结晶得到K2SO4晶体,符合题中各物质的转化关系,
(1)通过以上分析知,试剂a是 氨水,b是 稀硫酸,c是KOH溶液,故答案为:氨水;稀硫酸;KOH溶液;
(2)通过以上分析知,分离方法①是过滤,分离方法②是加热,分离方法③是蒸发结晶,
故答案为:过滤;加热;蒸发结晶;
(3)过滤、加热、蒸发结晶操作要用到的玻璃仪器有漏斗、烧杯、玻璃棒、酒精灯、蒸发皿、试管等,
故答案为:漏斗、烧杯、玻璃棒、酒精灯、蒸发皿、试管.
点评 本题考查物质的制备、混合物的分离和提纯,侧重考查学生基本操作、离子方程式的书写、实验方案设计等,能从整体上对流程进行分析解答,综合性较强,题目难度中等.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 已知2SO2(g)+O2(g)?2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 | |
| B. | 已知C(s,石墨)═C(s,金刚石)△H>0,则金刚石比石墨稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则任何酸碱中和反应的热效应均为57.3 kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |
| A. | 稀释 pH=4的醋酸,溶液中c(OH-)离子的浓度降低 | |
| B. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 | |
| C. | 0.2 mol/L的盐酸与等体积水混合后pH=1 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
| A. | 2NO2(g)?N2O4(g)(正反应放热) | B. | N2 (g)+O2(g)?2NO(g) (正反应吸热) | ||
| C. | 2SO2(g)+O2(g)?2SO3(g)(正反应放热) | D. | C(s)+H2O(g)?CO(g)+H2(g) (正反应吸热) |
| A. | 浓盐酸 | B. | 硫酸铜溶液 | C. | 稀硫酸 | D. | 浓硫酸 |
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+119 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 molNaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 在25℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量.则这些氢气完成燃烧生成气态水时,放出的热量比285.8 kJ还要多 |
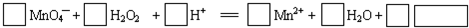
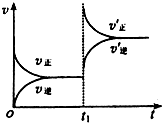 一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.
一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.