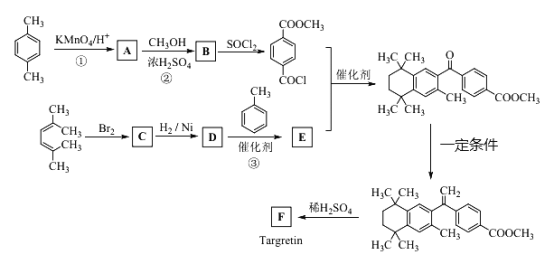
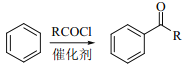
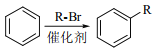
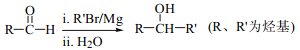题目内容
【题目】铜元素在电子、材料等领域应用广泛。回答下列问题:
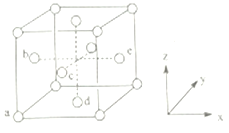
(1)基态铜的晶胞如图。它的空间利用率为____________,原子分数坐标a为(0,0,0);d为(1/2,1/2,0)。则e处的分数坐标为____________________。
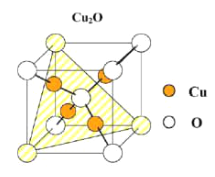
(2)氧化亚铜为半导体材料,晶胞结构如图,晶胞中有_________个氧化亚铜,该晶胞的边长为a pm,则此种氧化物的密度为_________g·cm-3(用NA表示阿伏加德罗常数的值)。
(3)向[Cu(NH3)4]SO4溶液通入适量SO2至微酸性,溶液蓝色褪去,铜离子被还原,产生白色沉淀(含有一种三角锥形阴离子和一种正四面体阳离子),化学反应方程式__________________。
【答案】 74% (0,1/2,1/2) 2 ![]() 2[Cu(NH3)4]SO4+3SO2+4H2O=2Cu(NH4)SO3↓+3(NH4)2SO4或2[Cu(NH3)4]SO4+3SO2+4H2O=Cu2SO3·(NH4)2SO3↓+3(NH4)2SO4
2[Cu(NH3)4]SO4+3SO2+4H2O=2Cu(NH4)SO3↓+3(NH4)2SO4或2[Cu(NH3)4]SO4+3SO2+4H2O=Cu2SO3·(NH4)2SO3↓+3(NH4)2SO4
【解析】本题主要考查晶胞结构。
(1)基态铜的晶胞含有4个铜原子,设晶胞边长为a,铜原子半径为r,则面对角线长![]() a=4r,即a=2
a=4r,即a=2![]() r,它的空间利用率为
r,它的空间利用率为![]() =74%,原子分数坐标a为(0,0,0);d为(1/2,1/2,0)。则e处的分数坐标为(0,1/2,1/2)。
=74%,原子分数坐标a为(0,0,0);d为(1/2,1/2,0)。则e处的分数坐标为(0,1/2,1/2)。
(2)晶胞中有2个氧化亚铜,该晶胞的边长为a pm,则此种氧化物的密度为![]() g·cm-3。
g·cm-3。
(3) 三角锥形阴离子为SO32-,正四面体阳离子为NH4+,白色沉淀为(NH4)2SO3,化学反应方程式为2[Cu(NH3)4]SO4+3SO2+4H2O=2Cu(NH4)SO3↓+3(NH4)2SO4或2[Cu(NH3)4]SO4+3SO2+4H2O=Cu2SO3·(NH4)2SO3↓+3(NH4)2SO4。

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案