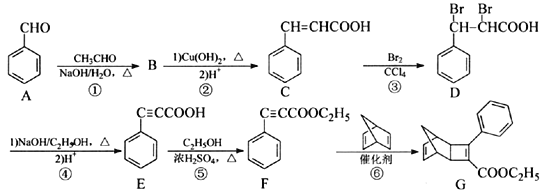
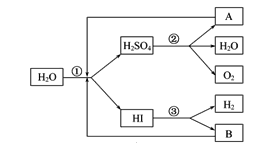
题目内容
【题目】目前世界上60%的镁是从海水中提取的,下图是某工厂从海水中提取镁的主要步骤。学生就这个课题展开了讨论。
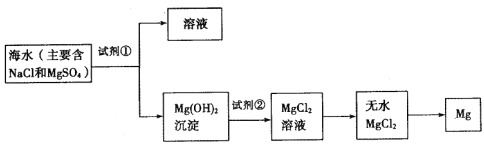
学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集,有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
通过分析比较你认为学生_______的观点正确(填学生序号),简述理由:______________________。
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,并充分利用当地的贝壳(主要成分为碳酸钙)资源,加入的足量试剂①是___________(填化学式)。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_________(填标号字母)
A.蒸馏 B.过滤 C.萃取 D.分液
(3)加入的足量试剂②是______________________(填化学式)。
(4)写出由无水MgCl2制取金属镁的化学方程式________________。
【答案】丙 镁离子富集浓度高;能源消耗小,成本低 Ca(OH)2(或CaO) B HCl MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
从含有NaCl和MgCl2的溶液中加入碱,使得Mg2+沉淀生成Mg(OH)2,Mg(OH)2加入盐酸得到MgCl2溶液,最后得到MgCl2固体,电解熔融的MgCl2得到Mg单质。
(一)镁离子的富集过程中,学生甲和学生乙的观点能源消耗大,成本高,学生丙的观点更为合理;
(二) (1)充分利用当地的贝壳(主要成分为碳酸钙)资源,碳酸钙高温分解成CaO,CaO与水作用得Ca(OH)2,使镁离子沉淀下来,可以选择Ca(OH)2或CaO;
(2)加入试剂①后,得到Mg(OH)2沉淀,可以采用过滤的方法分离,故选B;
(3)加入试剂②,将氢氧化镁转化为氯化镁,故试剂②为HCl;
(4)制取金属镁采用电解的方法,其反应方程式为:MgCl2 ![]() Mg+Cl2↑;
Mg+Cl2↑;

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案