题目内容
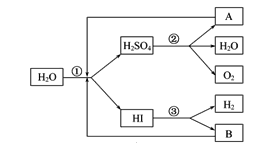
【题目】人类研究氢能源从未间断过,而热化学循环分解水制 H2是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为H2和O2,这是一种节约能源、节省反应物料的技术,下图是热化学循环制氢气的流程:
(1)实验测得,1 g H2燃烧生成液态水放出142.9 kJ的热量,则表示氢气燃烧热的热化学方程式为_______。
(2)整个流程参与循环的物质是________和________(填化学式),最难进行的反应是____________(填序号)。
(3)汞虽然有毒,但用途广泛。用汞和溴化钙作催化剂,可以在较低温度下经过下列反应使水分解制氢气和氧气:①CaBr2+2H2O=Ca(OH)2+2HBr↑;②……③HgBr2+Ca(OH)2=CaBr2+HgO+H2O;④2HgO=2Hg+O2↑。反应②的化学方程式为________________________。
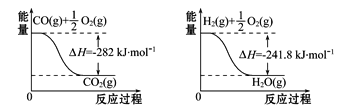
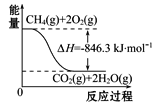
(4)合成氨用的H2可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
【答案】H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 SO2I2②Hg+2HBr=HgBr2+H2↑CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1
【解析】
(1)1g氢气燃烧生成液态水放出142.9kJ热量,则2g氢气即1mol氢气燃烧生成液态水放出285.8kJ的热量,则表示氢气燃烧的热化学方程式为H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol;综上所述,本题答案是:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 。
(2)反应①为:二氧化硫和碘单质和水反应:SO2+I2+2H2O═H2SO4+2HI,反应②为:硫酸分解生成二氧化硫、水、氧气:2H2SO4=2SO2↑+O2↑+2H2O,反应③为:碘化氢分解2HIH2+I2,整个流程参与循环的物质是SO2、I2,最难进行的反应是②;综上所述,本题答案是:SO2 ; I2 ; ②。
(3)根据反应③知反应②有HgBr2生成,根据HgBr2知反应①的产物HBr参与反应②,所以反应②为:Hg+2HBr═HgBr2+H2↑;因此本题答案是:Hg+2HBr=HgBr2+H2↑。
(4)由三个图可写出相应的热化学方程式:CO(g)+1/2O2(g)═CO2(g) △H=-282kJmo-1①H2(g)+1/2O2(g)═H2O(g)△H=-241.8kJmo-1②CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-846.3kJmo-1③,由盖斯定律:用“③-(①+②×3)”得所求反应的△H=+161.1kJmo-1,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+161.1 kJmol-1;综上所述,本题答案是:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1。