题目内容
下表是元素周期表的一部分,回答下列有关问题: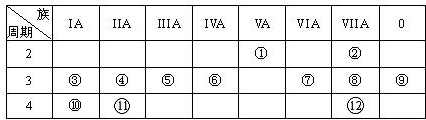
(1)写出下列元素符号:①
(2)画出原子的结构示意图:④
 ,⑧
,⑧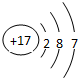
 ;
;
(3)在①~12元素中,金属性最强的元素是
(4)元素3、10、11的氢氧化物碱性由强到弱的顺序
(5)第三周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:

(1)写出下列元素符号:①
N
N
,⑥Si
Si
,⑦S
S
.(2)画出原子的结构示意图:④




(3)在①~12元素中,金属性最强的元素是
钾
钾
,非金属性最强的元素是氟
氟
,最不活泼的元素是氩
氩
.(均填元素名称)(4)元素3、10、11的氢氧化物碱性由强到弱的顺序
KOH>Ca(OH)2>NaOH
KOH>Ca(OH)2>NaOH
;元素6、7、8的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl
SiH4<H2S<HCl
(均用化学式填空)(5)第三周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:
Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
;Al(OH)3+3H+═Al3++3H2O
Al(OH)3+3H+═Al3++3H2O
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.写出能验证⑦的非金属性强于A的化学反应的离子方程式:
| ||
2H++CO32-═CO2↑+H2O或H++HCO3-═CO2↑+H2O
2H++CO32-═CO2↑+H2O或H++HCO3-═CO2↑+H2O
.分析:由元素在周期表中的位置可知,①为氮元素,②为氟元素,③为钠元素,④为镁元素,⑤为铝元素,⑥为硅元素,⑦为硫元素,⑧为氯元素,⑨为氩元素,⑩为钾元素,11为钙元素,12为溴元素,并利用原子的结构及元素、化合物的性质来解答各小问.
解答:解:(1)由元素在周期表中的位置可知,①为氮元素,其元素符号为N,⑥为硅元素,其元素符号为Si,⑦为硫元素,其元素符号为S,故答案为:N;Si;S;
(2)由元素在周期表中的位置可知,④为镁元素,其原子结构示意图为 ,⑧为氯元素,其原子结构示意图为
,⑧为氯元素,其原子结构示意图为 ,
,
故答案为: ;
; ;
;
(3)由同周期从左到右金属性在减弱,非金属性在增强,同主族从上到下金属性在增强,非金属性在减弱可知,在①~12元素中,钾元素的金属性最强,
氟元素的非金属性最强,氩原子的最外层电子数为8,为稳定结构,则氩最不活泼,故答案为:钾;氟;氩;
(4)金属性K>Ca>Na,则氢氧化物碱性由强到弱的顺序为KOH>Ca(OH)2>NaOH,非金属性Si<S<Cl,则氢化物稳定性由弱到强的顺序SiH4<H2S<HCl,
故答案为:KOH>Ca(OH)2>NaOH;SiH4<H2S<HCl;
(5)第三周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,则该水化物为氢氧化铝,具有两性,则与烧碱反应的离子反应为Al(OH)3+OH-═AlO2-+2H2O,与稀硫酸反应的离子反应为
Al(OH)3+3H+═Al3++3H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;Al(OH)3+3H+═Al3++3H2O;
(6)与①和⑥都相邻的一种元素可能为碳,也可能为磷,由常用作原电池的电极,则A为碳,⑦为硫,其最高价氧化物的水化物浓溶液为浓硫酸,则碳与浓硫酸的反应为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,利用强酸制取弱酸的反应原理及非金属性越强、其最高价氧化物的水化物的酸性越强可知,硫酸与碳酸盐或碳酸氢盐反应生成碳酸,
离子反应为2H++CO32--═CO2↑+H2O或H++HCO3-═CO2↑+H2O,
故答案为:C+2H2SO4(浓)
CO2↑+2 SO2↑+2H2O;2H++CO32-═CO2↑+H2O或H++HCO3-═CO2↑+H2O.
(2)由元素在周期表中的位置可知,④为镁元素,其原子结构示意图为
 ,⑧为氯元素,其原子结构示意图为
,⑧为氯元素,其原子结构示意图为 ,
,故答案为:
 ;
; ;
;(3)由同周期从左到右金属性在减弱,非金属性在增强,同主族从上到下金属性在增强,非金属性在减弱可知,在①~12元素中,钾元素的金属性最强,
氟元素的非金属性最强,氩原子的最外层电子数为8,为稳定结构,则氩最不活泼,故答案为:钾;氟;氩;
(4)金属性K>Ca>Na,则氢氧化物碱性由强到弱的顺序为KOH>Ca(OH)2>NaOH,非金属性Si<S<Cl,则氢化物稳定性由弱到强的顺序SiH4<H2S<HCl,
故答案为:KOH>Ca(OH)2>NaOH;SiH4<H2S<HCl;
(5)第三周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,则该水化物为氢氧化铝,具有两性,则与烧碱反应的离子反应为Al(OH)3+OH-═AlO2-+2H2O,与稀硫酸反应的离子反应为
Al(OH)3+3H+═Al3++3H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;Al(OH)3+3H+═Al3++3H2O;
(6)与①和⑥都相邻的一种元素可能为碳,也可能为磷,由常用作原电池的电极,则A为碳,⑦为硫,其最高价氧化物的水化物浓溶液为浓硫酸,则碳与浓硫酸的反应为C+2H2SO4(浓)
| ||
离子反应为2H++CO32--═CO2↑+H2O或H++HCO3-═CO2↑+H2O,
故答案为:C+2H2SO4(浓)
| ||
点评:本题考查位置、结构、性质的应用,明确周期表中的元素、熟悉物质的性质是解答本题的关键,注意应用非金属性与金属性的比较方法来解答.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是