题目内容
9.等物质的量的乙烷、乙烯、乙炔完全燃烧消耗氧气的物质的量之比为( )| A. | 1:1:1 | B. | 30:35:42 | C. | 5:4:3 | D. | 7:6:5 |
分析 1molCxHy完全燃烧,耗氧量为(x+$\frac{y}{4}$)mol,据此计算解答即可.
解答 解:1mol烃的耗氧量=(x+$\frac{y}{4}$)mol,1mol乙烷的耗氧量=(x+$\frac{y}{4}$)mol=(2+$\frac{6}{4}$)mol=3.5mol,1mol乙烯的耗氧量=(x+$\frac{y}{4}$)mol=3mol
1mol乙炔的耗氧量=(x+$\frac{y}{4}$)mol=2.5mol,故乙烷、乙烯、乙炔完全燃烧消耗氧气的物质的量之比为3.5mol:3mol:2.5mol=7:6:5,故选:D.
点评 本题考查耗氧量的判断,难度不大,注意利用燃烧的通式进行解答,将烃及烃的含氧衍生物用同一通式进行表达.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
2.已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在.以Al-H2O2燃料电池电解尿素的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极).下列说法不正确的是( )
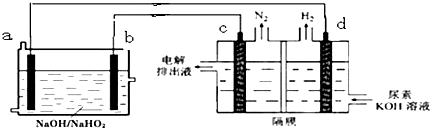

| A. | 电解过程中,电子的流向由a→b→c→d | |
| B. | 电极b是正极,且反应后该电极区pH增大 | |
| C. | 燃料电池的总反应为:2Al+3HO2-=2AlO2-+OH-+H2O | |
| D. | 电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L |
20.下列关于元素周期表的结构的叙述中正确的是( )
| A. | 除短周期外,其他周期均有18种元素 | |
| B. | 副族元素中没有非金属元素 | |
| C. | 周期表中的第三列是ⅢA | |
| D. | 在过渡元素区能找到大量单质半导体材料 |
17.将一定量的醇等分成两份,取一份充分燃烧可生成0.2mol CO2,另一份与足量Na作用放出0.1mol H2,则该醇不可能是( )
| A. | 甲醇 | B. | 乙二醇 | C. | 异丙醇 | D. | 甘油 |
14.下列科学家对发现元素周期律贡献最大的是( )
| A. | 拉瓦锡 | B. | 道尔顿 | C. | 阿伏加德罗 | D. | 门捷列夫 |