题目内容
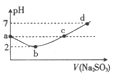
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )

A. 两烧杯中溶液的pH均增大
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中铜片表面均无气泡产生
D. 产生气泡的速度甲比乙慢
【答案】A
【解析】A、甲烧杯中可以形成原电池,乙烧杯不能形成原电池,但是两烧杯中的反应均为Zn+H2SO4=ZnSO4+H2↑,随着H2SO4的消耗,溶液酸性减弱,pH均增大,A正确。B、甲烧杯形成的原电池,Zn失去电子做负极,Cu做正极;乙烧杯不能形成原电池。B错误。C、甲烧杯中Cu正极反应为2H++2e-=H2↑,所以Cu表面有气泡产生;乙烧杯Zn直接参加反应产生H2,Cu表面无明显现象,C错误。D、甲烧杯形成原电池使反应更迅速,所以产生气泡速度甲比乙快,D错误。正确答案A。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g)+N2(g) ![]() 2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下表。下列叙述正确的是
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下表。下列叙述正确的是
容器编号 | 起始反应物 | 达到平衡的时间(min) | 平衡时N2的浓度(mol/L) | 平衡时气体密度 |
甲 | 3molH2、2molN2 | t1 | c1 | ρ1 |
乙 | 6molH2、4molN2 | 5 | 1.5 | ρ2 |
丙 | 2molNH3 | 8 | c3 | ρ3 |
A. 2ρ1=ρ2>ρ3
B. 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.05mol/(L·min)
C. c1<c3
D. 2c1<1.5
【题目】碳、硫和氮的氧化物与大气污染密切相关,对CO2、SO2和NO2的研究很有意义.
(1)科学家发现NOx与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(g) ![]() NaNO3(g)+ClNO(g) ΔH1<0(平衡常数为K1)
NaNO3(g)+ClNO(g) ΔH1<0(平衡常数为K1)
II:2NO(g)+ Cl(g) ![]() 2ClNO(g) ΔH2<0(平衡常数为K2)
2ClNO(g) ΔH2<0(平衡常数为K2)
III:4NO2(g)+2NaCl(g) ![]() 2NaNO2(g)+2NO(g)+Cl2(g) ΔH3 (平衡常数为K3)
2NaNO2(g)+2NO(g)+Cl2(g) ΔH3 (平衡常数为K3)
反应III中K3=___________(用K1、K2表示),ΔH3 =_______(用ΔH1、ΔH2表示)。若反应II在恒温、恒容条件下进行,能判断该反应一定达到平衡状态的标志是________________。
A.容器内混合气体的压强保持不变
B.v正(NO)=v逆(Cl2)
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子质量保持不变
(2)汽车尾气中排放的NOx和CO会污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOx和CO的排放,为了模拟应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如下表:
时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
平衡时,NO的转化率ɑ(NO)=_________________,
此溫度下,该反应的平衡常数K=_______________。
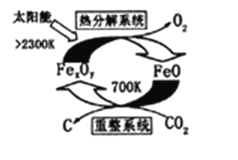
(3)科学家提出由CO2制取C的工艺如图所示。已知:在重整系统中n(FeO): n(CO2)=5 : 1则在“热分解系统”中,FexOy的化学式为__________________。
(4)NQx可“变废为宝”,由NO电解可制备NH4NO3,其工作原理如图所示(M、N为多孔电极)。为使电解产物全部转化为NH4NO3,需向电解产物中补充适量NH3。电解时M和电源________极(填“正或负”)相连,书写N极发生的电极反应式_____________________。