题目内容
【题目】把9.0g乙二酸和某二元醇混合,在一定条件下完全酯化,生成W g环酯和3.6g水,则该醇的相对分子质量可以表示为( )
A. 10W﹣54 B. 5W+13.5 C. 45(W﹣3.6) D. 2W+10.8
【答案】A
【解析】乙二酸与该二元醇按物质的量之比1:1恰好完全酯化,反应关系式可表示为:
C2H2O4 +醇→酯+2H2O
90 M 36
9.0 0.1M W 3.6
根据质量守恒:9.0+0.1M=W+3.6,所以M=10(W+3.6-9.0)=10W-54,答案选A。

【题目】甲醇又称“木精”,是非常重要的化工原料。
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇。根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式______。
化学键 | H-H | O-H | C-H | C-O | C=O |
键能/KJ·mol-1 | 436 | 463 | 413 | 351 | 1076 |
(2)甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。

①该脱氢反应的ΔH___0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)___V(逆)(填“>”、“<”或“=”),判断依据是_____
③下列叙述不能说明该脱氢反应已经达到平衡状态的是_____。
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸。已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13。
常温下,将20mL0.10mol·L-1CH3COOH溶液和20mL0.10mol·L-1HSCN溶液分别与20mL0.10mol·L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如下图所示:

①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是_______,反应结束后所得两溶液中,C(CH3COO-)____ c(SCN-)(填“>”、“<”或“=”)。
②常温条件下,将amol·L-1的CH3COOH与bmol·L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_______。
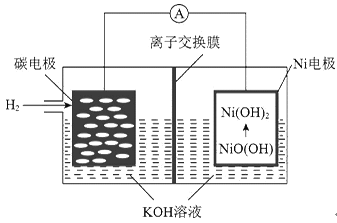
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体电极的电极反应式为___________。