题目内容
【题目】碳、硫和氮的氧化物与大气污染密切相关,对CO2、SO2和NO2的研究很有意义.
(1)科学家发现NOx与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(g) ![]() NaNO3(g)+ClNO(g) ΔH1<0(平衡常数为K1)
NaNO3(g)+ClNO(g) ΔH1<0(平衡常数为K1)
II:2NO(g)+ Cl(g) ![]() 2ClNO(g) ΔH2<0(平衡常数为K2)
2ClNO(g) ΔH2<0(平衡常数为K2)
III:4NO2(g)+2NaCl(g) ![]() 2NaNO2(g)+2NO(g)+Cl2(g) ΔH3 (平衡常数为K3)
2NaNO2(g)+2NO(g)+Cl2(g) ΔH3 (平衡常数为K3)
反应III中K3=___________(用K1、K2表示),ΔH3 =_______(用ΔH1、ΔH2表示)。若反应II在恒温、恒容条件下进行,能判断该反应一定达到平衡状态的标志是________________。
A.容器内混合气体的压强保持不变
B.v正(NO)=v逆(Cl2)
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子质量保持不变
(2)汽车尾气中排放的NOx和CO会污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOx和CO的排放,为了模拟应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如下表:
时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
平衡时,NO的转化率ɑ(NO)=_________________,
此溫度下,该反应的平衡常数K=_______________。
(3)科学家提出由CO2制取C的工艺如图所示。已知:在重整系统中n(FeO): n(CO2)=5 : 1则在“热分解系统”中,FexOy的化学式为__________________。

(4)NQx可“变废为宝”,由NO电解可制备NH4NO3,其工作原理如图所示(M、N为多孔电极)。为使电解产物全部转化为NH4NO3,需向电解产物中补充适量NH3。电解时M和电源________极(填“正或负”)相连,书写N极发生的电极反应式_____________________。
【答案】 ![]() 2ΔH1-ΔH2 ABD 90% 5×l03或5000 Fe5O7 负 NO-3e-+2H2O=
2ΔH1-ΔH2 ABD 90% 5×l03或5000 Fe5O7 负 NO-3e-+2H2O=![]() +4H+
+4H+
【解析】(1)2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 △H<0 (I),2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g) K1 △H<0 (I),2NO(g)+Cl2(g)![]() 2ClNO(g) K2 △H<0 (II),根据盖斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)
2ClNO(g) K2 △H<0 (II),根据盖斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=K12/K2,ΔH3 =2ΔH1-ΔH2,A.反应前后气体物质的量变化,容器内压强不再变化,说明反应达到平衡状态,故A正确;B.反应速率之比等于化学方程式计量数之比,υ 正 ( NO )=υ正 ( Cl2 ),υ 正 ( NO )=υ 逆 ( Cl2 )说明正逆反应速率相同,故B正确;C.质量和体积不变,气体混合气体密度始终不变,不能说明反应达到平衡状态,故C错误;D.该反应属于气体的物质的量发生变化的反应,气体的质量不变,因此混合气体的平均相对分子质量保持不变,能说明反应达到平衡状态,故D正确;故答案为:K12/K2;2ΔH1-ΔH2;ABD;
2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=K12/K2,ΔH3 =2ΔH1-ΔH2,A.反应前后气体物质的量变化,容器内压强不再变化,说明反应达到平衡状态,故A正确;B.反应速率之比等于化学方程式计量数之比,υ 正 ( NO )=υ正 ( Cl2 ),υ 正 ( NO )=υ 逆 ( Cl2 )说明正逆反应速率相同,故B正确;C.质量和体积不变,气体混合气体密度始终不变,不能说明反应达到平衡状态,故C错误;D.该反应属于气体的物质的量发生变化的反应,气体的质量不变,因此混合气体的平均相对分子质量保持不变,能说明反应达到平衡状态,故D正确;故答案为:K12/K2;2ΔH1-ΔH2;ABD;
(2) 根据表格数据,平衡时,NO的转化率ɑ(NO)= ![]() ×100%=90%;此溫度下,平衡时,NO、CO、N2、CO2的浓度分别为1.0×10-4mol/L、2.7×10-3mol/L、4.5×10-4mol/L、9.0×10-4mol/L,该反应的平衡常数K=
×100%=90%;此溫度下,平衡时,NO、CO、N2、CO2的浓度分别为1.0×10-4mol/L、2.7×10-3mol/L、4.5×10-4mol/L、9.0×10-4mol/L,该反应的平衡常数K=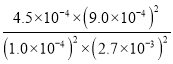 =5000,故答案为:90%;5000;
=5000,故答案为:90%;5000;
(3)由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO):n(CO2)=5:1,根据Fe原子、O原子守恒可知x:y=5:(5+2)=5:7,故FexOy的化学式为Fe5O7,故答案为:Fe5O7;
(4)电解NO制备NH4NO3,由图可知N为阳极反应为NO-3e-+2H2O=NO3-+4H+,M为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3。根据以上分析,M为阴极,和电源负极相连N为阳极,反应式为NO-3e-+2H2O=NO3-+4H+,故答案为:负;NO-3e-+2H2O=NO3-+4H+。
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3。根据以上分析,M为阴极,和电源负极相连N为阳极,反应式为NO-3e-+2H2O=NO3-+4H+,故答案为:负;NO-3e-+2H2O=NO3-+4H+。

 智能训练练测考系列答案
智能训练练测考系列答案