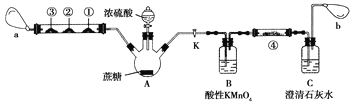
��Ŀ����
����Ŀ�����Ļ�������ũҩ��������ҵ����ҵ��������;�dz��㷺���������ʾ�ش�����������⣺
��1����̬��ԭ�ӵļ۲�����Ų�ʽΪ__________________��̼��������Ԫ�صĵ�һ��������С�����˳��Ϊ_________________����Ԫ�ط��ű�ʾ����
��2��NH4Cl�е�ԭ�ӵ��ӻ���ʽΪ____________����NH4����Ϊ�ȵ������һ�ַǼ��Է��ӵĻ�ѧʽΪ_______________��
��3��NH4Cl�����ֽ������������CuSO4��Һ��ͨ�백����������������ɫ�������������ܽ�õ�����ɫ��Һ������Һ�д��ڵ������ӵĽṹʽΪ___________________��
��4������NH3����좣�PH3����������������̬�⻯�����Ƿֱ�Ϊ107���93.6�㣬�Է���PH3�ļ���С��NH3��ԭ��__________________________________________________��
��5����VA����̬�⻯��е�����ͼ��ʾ���Խ��ͷе�PH33��PH333��ԭ��____________________________________________________________________��

��6���������Ǿ�����ҪӦ�ü�ֵ�İ뵼�壬�䲿�־���ṹ����ͼ��ʾ��ÿ��������Gaԭ�Ӹ���Ϊ____�����������ױ߳�Ϊa nm����Ϊc nm�����صľ����ܶ�Ϊ___________g/cm3
���ú�a��c�Ĵ���ʽ��ʾ�������ӵ�������NA��ʾ����

���𰸡� 2s22p3 C��O��N sp3 CH4 ![]() N�ĵ縺��ǿ��P���Գɼ����Ӷ�����������ǿ���ɼ����Ӷ�������ԭ�Ӹ������ɼ����Ӷ�֮������С���ų���������ʹ���Ǹ������PH3�ļ���С��NH3�� NH3���Ӽ������������ӽṹ���ƣ���Է����������������Ӽ�������������ǿ 6
N�ĵ縺��ǿ��P���Գɼ����Ӷ�����������ǿ���ɼ����Ӷ�������ԭ�Ӹ������ɼ����Ӷ�֮������С���ų���������ʹ���Ǹ������PH3�ļ���С��NH3�� NH3���Ӽ������������ӽṹ���ƣ���Է����������������Ӽ�������������ǿ 6 ![]() g/cm3
g/cm3
����������1����Ԫ�صĺ˵����Ϊ7����ԭ���������5�����ӣ����̬��ԭ�ӵļ۲�����Ų�ʽΪ2s22p3��̼��������Ԫ�ؾ�Ϊ�ڶ���������Ԫ�أ���һ������������ƣ�������2p���Ϊ������ṹ������ȶ�����һ����ƫ��������Ԫ�صĵ�һ��������С�����˳��ΪC��O��N��
��2��NH4+�����м۲���Ӷ�=4+![]() =4����������ԭ��ԭ�ӹ��Ϊsp3�ӻ�����VSEPRģ��Ϊ�������壬�������к��в��µ��Ӷԣ�������ռ乹��Ϊ�������壬NH4+�е�����Ϊ��7+4-1=10��ԭ����Ϊ5��CH4�е�����Ϊ��6+4=10��ԭ����Ϊ5����NH4+�ǵȵ����壻
=4����������ԭ��ԭ�ӹ��Ϊsp3�ӻ�����VSEPRģ��Ϊ�������壬�������к��в��µ��Ӷԣ�������ռ乹��Ϊ�������壬NH4+�е�����Ϊ��7+4-1=10��ԭ����Ϊ5��CH4�е�����Ϊ��6+4=10��ԭ����Ϊ5����NH4+�ǵȵ����壻
��3����CuSO4��ˮ��Һ����μ��백ˮ�����ӷ���ʽΪ��Cu2++2NH3H2O=Cu��OH��2��+2H2O�����������۲쵽��Һ������ɫ���ձ�Ϊ����ɫ������[Cu��NH3��4]2+����Ӧ�����ӷ���ʽΪ��Cu��OH��2+4NH3H2O=[Cu��NH3��4]2++2OH-+4H2O��[Cu��NH3��4]2+�ĽṹʽΪ![]() ��
��
��4������NH3����좣�PH3���ǵȵ�����ṹ���ƣ���N�ĵ縺��ǿ��P���Գɼ����Ӷ�����������ǿ���ɼ����Ӷ�������ԭ�Ӹ������ɼ����Ӷ�֮������С���ų���������ʹ���Ǹ������PH3�ļ���С��NH3��
��5����VA����̬�⻯��ṹ���ƣ���Ϊ���Ӿ��壬��Է�������Խ���Ӽ�������Խ�е�Խ�ߣ���NH3���Ӽ�����������е���ߣ�
��6��ÿ��������Gaԭ�Ӹ���Ϊ12��![]() +2��
+2��![]() +3=6��Nԭ��Ϊ6��
+3=6��Nԭ��Ϊ6��![]() +4=6��ÿ�������к���6��GaN��ÿ������������Ϊ
+4=6��ÿ�������к���6��GaN��ÿ������������Ϊ![]() �����������Ϊ
�����������Ϊ![]() a2cnm3=
a2cnm3=![]() a2c��10-21cm3���������ܶ�Ϊ
a2c��10-21cm3���������ܶ�Ϊ![]() ��[
��[![]() a2c��10-21cm3]=
a2c��10-21cm3]=![]() g/cm3��
g/cm3��

����Ŀ���״��ֳ���ľ�������Ƿdz���Ҫ�Ļ���ԭ�ϡ�
��1��CO��H2�ڸ��¡���ѹ�����������·�Ӧ���Ʊ��״��������±�����ػ�ѧ�����ܣ������Ƕ���1mol��ѧ��ʱ��Ҫ���յ����������γ�1mol��ѧ��ʱ�ͷŵ����������ݣ�д��CO��CO�����к���C=O����H2��Ӧ���ɼ״����Ȼ�ѧ����ʽ______��
��ѧ�� | H-H | O-H | C-H | C-O | C=O |
����/KJ��mol-1 | 436 | 463 | 413 | 351 | 1076 |
��2���״��������ȡ��ȩCH3OH��g��![]() HCHO(g)+H2(g),�״���ƽ��ת�������¶ȱ仯��������ͼ��ʾ��
HCHO(g)+H2(g),�״���ƽ��ת�������¶ȱ仯��������ͼ��ʾ��

�������ⷴӦ����H___0������>������<������=����
��600Kʱ��Y��״���V(��)___V(��)������>������<������=�������ж�������_____
��������������˵�������ⷴӦ�Ѿ��ﵽƽ��״̬����_____��
A.c��CH3OH��=c��HCHO�� B.HCHO������������ֲ���
C.V����CH3OH��=V�棨HCHO�� D.�������ƽ�����������ֲ���
��3��һ�������£��״���һ����̼��Ӧ���Ժϳ����ᡣ��֪�������£�������ʵĵ���ƽ�ⳣ����Ka��CH3COOH��=1.8��10-5��Ka��HSCN��=0.13��
�����£���20mL0.10mol��L-1CH3COOH��Һ��20mL0.10mol��L-1HSCN��Һ�ֱ���20mL0.10mol��L-1NaHCO3��Һ��ϣ�ʵ���ò���CO2�������V��ʱ��t�仯��ʾ��ͼ����ͼ��ʾ��

�ٷ�Ӧ��ʼ�Σ�������Һ����CO2��������ʴ������Բ����ԭ����_______����Ӧ��������������Һ�У�C��CH3COO-��____ c��SCN-��������>������<������=������
�ڳ��������£���amol��L-1��CH3COOH��bmol��L-1Ba��OH��2��Һ�������ϣ���Ӧƽ��ʱ��2c��Ba2+��=c��CH3COO-��,�ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ_______��
��4���״�ȼ�ϵ�ؿ��ܳ�Ϊδ����Я���Ӳ�ƷӦ�õ�������ij�ּ״�ȼ�ϵ�ع���ԭ����ͼ��ʾ����ͨ��a����缫�ĵ缫��ӦʽΪ___________��