题目内容
【题目】碳酸钠和碳酸氢钠都是中学常见化学药品。
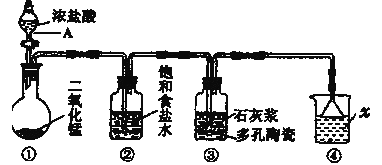
Ⅰ.下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的装置:
请回答下列问题(提示B分液漏斗中为浓氨水,滴入烧瓶可产生氨气):
(1)装置的连接顺序是:a接___,___接___;b接___。
(2)检查装置气密性后,必须先让___(填A或B)装置先发生反应。C中用球形干燥管而不用直导管,其作用是___。
(3)C中广口瓶内产生固体的总化学方程式为___。
Ⅱ.通过加热分解的方法可以测定碳酸钠和碳酸氢钠的含量。取13.08g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石灰水中,测得生成沉淀的质量为4.0g。
(4)加热时发生的化学反应方程式为___。
(5)原混合物中碳酸钠和碳酸氢钠的物质的量之比为___。
【答案】f e d c B 防倒吸 CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+H2O+CO2↑ 3:4
Na2CO3+H2O+CO2↑ 3:4
【解析】
(1)足量的CO2与NaOH反应生成NaHCO3,装置A产生CO2,装置B产生NH3,装置D除去二氧化碳中的HCl,氨气通入C中应防止倒吸,则b接c,故a接f、e接d,
故答案为:f;e;d;c;
(2)侯氏制碱法是利用氨气溶解性大,极易溶解于水,二氧化碳气体水中溶解性较小,饱和食盐水中先通入氨气,再通入二氧化碳气体;实验操作过程中,应让B装置先发生反应,氨气极易溶于水,用直导管向饱和氯化钠溶液中通入氨气,容易发生倒吸,C中用球形干燥管球形部分液面上升慢起缓冲作用,可以防止倒吸,
故答案为:B;防倒吸;
(3)侯氏制碱法,也称为联合制碱法,化学反应原理是用氨气和二氧化碳与氯化钠饱和溶液反应生成碳酸氢钠,然后加热碳酸氢钠制取碳酸钠,所以C中广口瓶内产生固体的总化学方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;
(4)加热时发生的化学反应方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑,
Na2CO3+H2O+CO2↑,
答案为:2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(5)4g沉淀为CaCO3,n(CaCO3)=![]() =0.04mol,根据反应关系式:CaCO3~CO2,可知n(CO2)=n(CaCO3)=0.04mol,根据反应关系式:2NaHCO3~CO2,n(NaHCO3)=2n(CO2)=2×0.04mol=0.08mol,原混合物中碳酸氢钠的质量为:n(NaHCO3)=84g/mol×0.08mol=6.72g,碳酸钠的质量为=13.08g-6.72g=6.36g,碳酸钠物质的量=
=0.04mol,根据反应关系式:CaCO3~CO2,可知n(CO2)=n(CaCO3)=0.04mol,根据反应关系式:2NaHCO3~CO2,n(NaHCO3)=2n(CO2)=2×0.04mol=0.08mol,原混合物中碳酸氢钠的质量为:n(NaHCO3)=84g/mol×0.08mol=6.72g,碳酸钠的质量为=13.08g-6.72g=6.36g,碳酸钠物质的量=![]() =0.06mol,则原混合物中碳酸钠和碳酸氢钠的物质的量之比为0.06mol:0.08mol=3:4。
=0.06mol,则原混合物中碳酸钠和碳酸氢钠的物质的量之比为0.06mol:0.08mol=3:4。
答案为:3:4。

 阅读快车系列答案
阅读快车系列答案