题目内容
错误的是
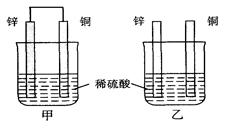
| A.电池负极(锌筒)的电极反应式为:Zn-2e-=Zn2+ |
| B.电池正极(石墨)的电极反应式为:2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
C
此题考查原电池知识,原电池的原理及其应用是历年高考的热点。根据原电池的总反应式写各电极反应式,首先分析总反应式中得失电子情况,得出锌失电子,是负极;二氧化锰得电子,碳棒是正极,分析电极反应式A、B选项正确。C选项,在原电池的外电路电子是由负极流向正极,错。D选项外电路中每通过0.2mol电子,也就是锌失0.2mol电子,所以有0.1mol锌失电子,故锌的质量理论上减小6.5g,对。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
 Fe2++2e-
Fe2++2e-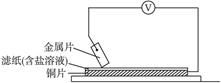
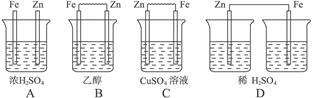
 2PbSO4+2H2O据此判断下列叙述
2PbSO4+2H2O据此判断下列叙述 PbSO4+2H2O
PbSO4+2H2O 方式插入同浓度的稀硫酸中一段时间,叙述正确的是
方式插入同浓度的稀硫酸中一段时间,叙述正确的是