题目内容
有一种原电池,它的一个电极材料是NiO2(在碱中NiO2氧化性比O2更强),还原产物是+2价镍的化合物,另一个电极是铁,电解质溶液是21%的KOH溶液,下列对电池的叙述和有关反应正确的是( )
| A.此电池必须密封,防止空气进入 |
B.铁是负极,放电时,铁失去电子形成能自由移动的Fe2+,负极反应是Fe Fe2++2e- Fe2++2e- |
| C.放电时,正极反应是NiO2+2e-====Ni2++2O2- |
| D.放电时总反应为Fe+NiO2+2H2O====Fe(OH)2+Ni(OH)2 |
AD
因电池的电解质是KOH溶液,应防止与空气接触,否则KOH会与空气中的CO2发生反应生成K2CO3,故A项正确,书写电池电极反应式时也要遵循离子反应的书写原则,能溶于水的强电解质才能写成离子。此外还要注意电解质溶液的酸碱性。在酸性溶液中,可能发生消耗H+或产生H+的反应,不可能发生消耗OH-或生成OH-的反应。在碱溶液中,一般可能发生消耗OH-或生成OH-的反应,不发生消耗H+或生成弱碱金属离子的反应,因而B、C两项是错误的。在KOH溶液中,负极反应的产物是Fe(OH)2,Fe+2OH- Fe(OH)2+2e-,正极反应为:NiO2+2H2O+2e-
Fe(OH)2+2e-,正极反应为:NiO2+2H2O+2e- Ni(OH)2+2OH-,故D项是正确的。
Ni(OH)2+2OH-,故D项是正确的。
 Fe(OH)2+2e-,正极反应为:NiO2+2H2O+2e-
Fe(OH)2+2e-,正极反应为:NiO2+2H2O+2e- Ni(OH)2+2OH-,故D项是正确的。
Ni(OH)2+2OH-,故D项是正确的。
练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。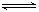
 Al(OH)4-+ H+ ②NH3+H2O
Al(OH)4-+ H+ ②NH3+H2O 2PbSO4+2H2O,当电压由2.0 V下降到1.85 V,应停止使用,进行充电,则阴极的电极反应式为( )
2PbSO4+2H2O,当电压由2.0 V下降到1.85 V,应停止使用,进行充电,则阴极的电极反应式为( ) Pb2++2H2O
Pb2++2H2O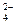
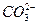 +7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-====8OH-,下列叙述正确的是( )
+7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-====8OH-,下列叙述正确的是( )