题目内容
【题目】在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO(g)+SO2(g) ![]() 2CO2(g)+S(l)。以疏松多孔的γAl2O3作为催化剂(其他条件相同),反应相同的时间,SO2的去除率随反应温度的变化如图所示(图中虚线表示相同条件下SO2的平衡去除率随温度的变化)。下列说法正确的是
2CO2(g)+S(l)。以疏松多孔的γAl2O3作为催化剂(其他条件相同),反应相同的时间,SO2的去除率随反应温度的变化如图所示(图中虚线表示相同条件下SO2的平衡去除率随温度的变化)。下列说法正确的是
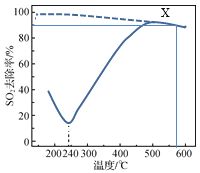
A.该反应的ΔH>0
B.180℃,SO2去除率较高的主要原因是SO2被γAl2O3吸附
C.500℃时,其他条件不变,采用高效的催化剂可以提高SO2去除率
D.X点恒容下再通入CO、CO2各0.1 mol,达到平衡前v(正)>v(逆)
【答案】B
【解析】
A.由虚线可知,温度升高,SO2的平衡去除率减小,则温度升高,平衡逆向移动,逆反应为吸热反应,则该反应的ΔH<0,A错误;
B.从图上看,500℃SO2去除率最高,说明500℃催化剂活性最好,500℃以下,温度升高催化剂活性增强,SO2去除率应该增大,但是180℃到240℃SO2去除率减小,结合题中催化剂为疏松多孔可知,180℃,SO2去除率较高的主要原因是SO2被γAl2O3吸附,180℃到240℃,SO2去除率减小的主要原因是随着温度升高,γAl2O3吸附SO2的量减小,B正确;
C.由图可知,500℃,SO2去除率为平衡去除率,换高效催化剂不能使平衡发生移动,SO2去除率不变,C错误;
D.设CO、SO2起始物质的量浓度分别为a mol·L-1、b mol·L-1,体积为1L,则 ,X点对应的平衡常数K=
,X点对应的平衡常数K=![]() ,恒容下再通入CO、CO2各0.1 mol,则Qc=
,恒容下再通入CO、CO2各0.1 mol,则Qc=![]() ,很显然,Qc和K的关系和CO、SO2起始a、b的关系有关,若1.8b+0.1>a-1.8b+0.1,即3.6b>a时,Qc>K,平衡逆向移动,v(正)<v(逆),3.6b=a时,Qc=K,平衡不移动,v(正)=v(逆),3.6b<a时,Qc<K,平衡正向移动,v(正)>v(逆),D错误。
,很显然,Qc和K的关系和CO、SO2起始a、b的关系有关,若1.8b+0.1>a-1.8b+0.1,即3.6b>a时,Qc>K,平衡逆向移动,v(正)<v(逆),3.6b=a时,Qc=K,平衡不移动,v(正)=v(逆),3.6b<a时,Qc<K,平衡正向移动,v(正)>v(逆),D错误。
答案选B。

 世纪百通期末金卷系列答案
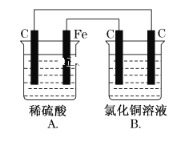
世纪百通期末金卷系列答案【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 制取少量纯净的CO2气体 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl饱和溶液制备NaCl晶体 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D