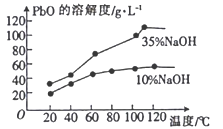
题目内容
【题目】某溶液中有①NH4+、②Mg2+、③Fe2+、④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.①② B.①③ C.②③ D.③④
【答案】A
【解析】
试题混合溶液中加入过量的NaOH并加热时,反应生成的氨气逸出,并同时生成Mg(OH)2、Fe(OH)2沉淀和NaAlO2。Fe(OH)2沉淀在空气中不稳定,迅速氧化生成Fe(OH)3。再向混合物中加入过量盐酸,则Mg(OH)2、Fe(OH)3和NaAlO2与过量酸作用分别生成MgCl2、AlCl3、FeCl3,则减少的离子主要有:NH4+和Fe2+,答案选A。

【题目】决定物质性质的重要因素是物质的结构。请回答下列问题。
(1)已知X和Y为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/(kJ/mol) | I1 | I2 | I3 | I4 |
X | 578 | 1817 | 2745 | 11578 |
Y | 738 | 1451 | 7733 | 10540 |
X通常显_____价,X的电负性____Y的电负性(填“>”“ =”或“<”)。
(2)紫外光的光子所具有的能量约为399kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:_______________。
共价键 | C-C键 | C-N键 | C-S键 |
键能/(kJ/mol) | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子的杂化类型是__________。
(3)实验证明:KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似(如图),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/(kJ.mol-1) | 786 | 715 | 3401 |

则这四种离子晶体的熔点从高到低的顺序是_______。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有______个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型化合物V2O5和CrO2中,适合作录音带磁粉原料的是_________。
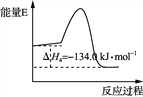
【题目】Ⅰ.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为_____________________________________________________。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应: CH4(g) + H2O(g) ![]() CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
时间/min 物质的浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
①该反应第一次达平衡时的平衡常数K=_______________。
②3min时改变的反应条件是__________________(只填一种条件的改变即可)。
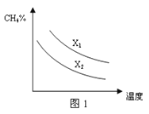
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。图1中的两条曲线所示投料比的关系X1 ______X2(填“=”、“>”或“<”)。
Ⅱ.(4)已知常温下HCOOH的电离常数为![]() ,则HCOO—的水解反应HCOO- + H2O
,则HCOO—的水解反应HCOO- + H2O ![]() HCOOH + OH-的平衡常数K h =__________________。
HCOOH + OH-的平衡常数K h =__________________。
(5)常温下,将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,溶液中各离子浓度由大到小的顺序是______________________________。
(6)常温下,在a mol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为______________________。
【题目】丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图所示:

①10.0 g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性。 ③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分。
可能用到的信息:
沸点 | 溶解性 | 着火点(闪点) | 毒性 | |
丙烯酸 | 1420C | 与水互溶,易溶于有机溶剂 | 540C | 有毒 |
甲醇 | 650C | 与水互溶,易溶于有机溶剂 | 110C | 有毒 |
丙烯酸甲酯 | 80.50C | 难溶于水,易溶于有机溶剂 | 不详 | 无毒 |
(注闪点低于500C属于极易燃烧物质)回答下列问题:
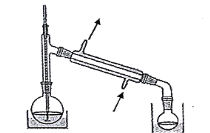
(1)仪器c的名称是____________。
(2)混合液用5% Na2CO3溶液洗涤的目的是_____________.
(3)请写出配制100 g 5% Na2CO3溶液所使用的玻璃仪器____________。
(4)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出_____________、________________________.
为检验产率,设计如下实验:
①.油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5 mol/L的KOH溶液10.00 mL,加热使之完全水解。
②.用酚酞做指示剂,向冷却后的溶液中滴加0.5 mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00 mL。
(5)计算本次酯化反应丙烯酸的转化率____。
(6)请列举2条本实验中需要采取的安全防护措施___________________________________________.
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。
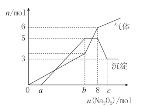
下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成