题目内容
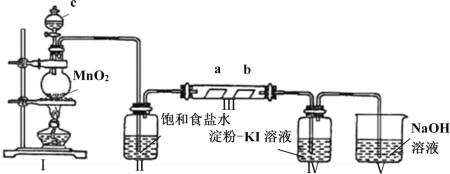
【题目】Ⅰ.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为_____________________________________________________。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应: CH4(g) + H2O(g) ![]() CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
时间/min 物质的浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
①该反应第一次达平衡时的平衡常数K=_______________。
②3min时改变的反应条件是__________________(只填一种条件的改变即可)。
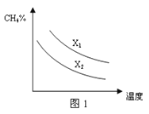
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。图1中的两条曲线所示投料比的关系X1 ______X2(填“=”、“>”或“<”)。
Ⅱ.(4)已知常温下HCOOH的电离常数为![]() ,则HCOO—的水解反应HCOO- + H2O
,则HCOO—的水解反应HCOO- + H2O ![]() HCOOH + OH-的平衡常数K h =__________________。
HCOOH + OH-的平衡常数K h =__________________。
(5)常温下,将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,溶液中各离子浓度由大到小的顺序是______________________________。
(6)常温下,在a mol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为______________________。
【答案】CH4(g) + H2O(g)=CO(g) + 3H2(g) △H=+206kJ/mol0.135升高温度或增大c(H2O)>5×![]() c(HCOO-)>c(Na+)>c(H+) >c(OH-)(a-b)/2
c(HCOO-)>c(Na+)>c(H+) >c(OH-)(a-b)/2
【解析】
(1)根据热化学方程式的书写方法,先写出方程式并标注状态,再根据热量与化学计量数计算焓变,则用甲烷与水蒸气制备合成气,每生成1mol合成气,需要吸收51.5KJ热量,该反应的热化学方程式为: CH4(g) + H2O(g)=CO(g) + 3H2(g) △H=+206kJ/mol;
(2)①反应方程式为: CH4(g) + H2O(g)=CO(g) + 3H2(g),
初起量(mol/L) 0.2 0.3 0 0
变化量(mol/L) 0.1 0.1 0.1 0.3
平衡量(mol/L) 0.1 0.2 0.1 0.3
所以![]() ;
;
②3min时改变的反应条件,反应向正反应方向进行,可能为升高温度或增大H2O的浓度;
(3)碳水比X[n(CH4)/n(H2O)]值越大,平衡时甲烷的转化率越低,含量越高,故X1 >X2;
(4)醋酸的电离平衡常数为![]() ,醋酸根离子水解的平衡常数为:
,醋酸根离子水解的平衡常数为:![]() ,已知
,已知![]() ,由以上公式可知
,由以上公式可知![]() ;
;
(5)将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,得到的是等浓度的甲酸钠和甲酸的混合物,溶液显示酸性,甲酸的电离程度大于甲酸根离子的水解程度,离子浓度大小顺序是:c(HCOO-)>c(Na+)>c(H+) >c(OH-);
(6)根据溶液显示中性,所以c(OH-)=C(H+),根据电荷守恒,得到c(HCOO-)=c(Na+),根据物料守恒,溶液中c(HCOOH)=(a-b)/2 mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案