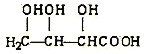题目内容
【题目】我国利用合成气直接制烯烃获重大突破,其原理是( )
反应①:C(s)+1/2O2(g)=CO(g) ΔH1
反应②:C(s)+H2O(g)=CO(g)+H2(g) ΔH2
反应③:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.1 kJ·mol-1
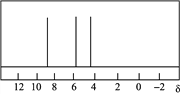
反应④:2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4,能量变化如下图所示

反应⑤:3CH3OH(g)=CH3CH=CH2(g)+3H2O(g) ΔH5=-31.0 kJ·mol-1
下列说法正确的是( )
A. 反应③使用催化剂,ΔH3减小
B. 反应④中正反应的活化能大于逆反应的活化能
C. ΔH1-ΔH2<0
D. 3CO(g)+6H2(g)→CH3CH===CH2(g)+3H2O(g) ΔH=-121.1 kJ·mol-1
【答案】C
【解析】A.催化剂不能改变焓变,A错误;B.反应④是放热反应,其中正反应的活化能小于逆反应的活化能,B错误;C.根据盖斯定律:①-②即得到氢气燃烧的热化学方程式,氢气燃烧放热,所以ΔH1-ΔH2<0,C正确;D.根据盖斯定律:③×3+⑤得3CO(g)+6H2(g)→CH3CH=CH2(g)+3H2O(g)△H=-301.3kJmol-1,D错误,答案选C。

【题目】有机物X(分子式为C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂内为多。经测定该有机物具有下列性质(见下表)。请根据题目要求填空:
X的性质 | |
① | X与足量的金属钠反应产生氢气 |
② | X与醇或羧酸在浓硫酸加热条件下均能生成有香味的产物 |
③ | 在一定条件下X的分子内脱水产物(不是环状化合物)可与溴水发生加成反应 |
④ | 33.5gX与100mL的5mol/LNaOH溶液恰好完全中和 |
(1)X的可能结构简式I:________,Ⅱ:__________,Ⅲ:__________。
(2)在一定条件下有机物X可发生化学反应的类型有(填序号)__________。
A.水解反应 B.取代反应 C.加成反应 D.消去反应 E.加聚反应 F.中和反应
(3)下列物质与X互为同系物的是(填序号)_______,与X互为同分异构体的是(填序号)_______。
(a)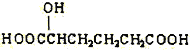 (b)
(b)![]()
(c)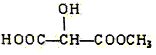 (d)H3COOC-COOCH3
(d)H3COOC-COOCH3
(e)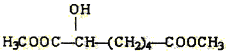 (f)
(f)