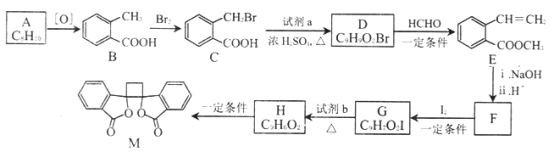
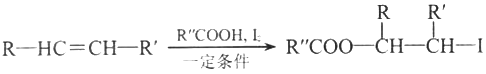
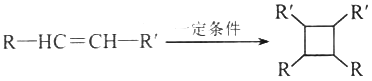题目内容
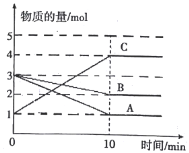
【题目】将一定量的A、B、C三种物质(都是气体)放入固定体积为1L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如下图所示。请回答下列问题:
(1)反应的化学方程式用A、B、C可表示为____________。
(2)用A表示在0~10min内的反应速率____________。
(3)在该条件达到反应的限度时反应物B的转化率为_____________。(计算结果用百分数表示,并保留1位小数)
(4)开始时容器中的压强与平衡时的压强之比为_____________。
【答案】 2A(g)+B(g)![]() 3C(g) 0.2mol/(L·min) 33.3% 1:1
3C(g) 0.2mol/(L·min) 33.3% 1:1
【解析】(1)A、B物质的量随着时间的推移逐渐减小至不变,A、B为反应物;C的物质的量随着时间的推移逐渐增大至不变,C为生成物;10min后A、B、C物质的量保持不变都不等于0,该反应为可逆反应;根据0~10min内A、B、C转化物质的量之比等于化学计量数之比配平。
(2)根据速率的计算公式计算υ(A)。
(3)10min后B的物质的量保持2mol不变,即达到反应限度时B的物质的量为2mol,根据转化率的含义计算B的转化率。
(4)恒温恒容时气体的压强之比等于气体分子物质的量之比(或结合该反应的特点判断)。
(1)A、B物质的量随着时间的推移逐渐减小至不变,A、B为反应物;C的物质的量随着时间的推移逐渐增大至不变,C为生成物;10min后A、B、C物质的量保持不变都不等于0,该反应为可逆反应;根据0~10min内A、B、C转化物质的量分别为(3-1)mol、(3-2)mol、(4-1)mol,根据转化物质的量之比等于化学计量数之比,反应的化学方程式为2A(g)+B(g)![]() 3C(g)。
3C(g)。
(2)0~10min内υ(A)=![]() =
=![]() =0.2mol/(L·min)。
=0.2mol/(L·min)。
(3)10min后B的物质的量保持2mol不变,即达到反应限度时B的物质的量为2mol,B的转化率α(B)=![]() 100%=33.3%。
100%=33.3%。
(4)根据图像,开始时容器中气体物质的量之和为3mol+3mol+1mol=7mol,平衡时混合气体物质的量之和为1mol+2mol+4mol=7mol;恒温恒容时气体的压强之比等于气体分子物质的量之比,开始时容器中的压强与平衡时的压强之比等于开始时气体物质的量与平衡时气体物质的量之比,为1:1。(或该反应的特点是:反应前后气体分子数不变,开始时和平衡时气体总物质的量相等,在恒温恒容容器中,开始时容器中的压强与平衡时的压强相等,开始时容器中的压强与平衡时的压强之比为1:1。)

 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】下列四个试管中,过氧化氢分解产生氧气的反应速率最快的是 ( )
试管 | 温度 | 过氧化氢溶液浓度 | 催化剂 |
A | 常温 | 3% | — |
B | 常温 | 6% | — |
C | 水浴加热 | 3% | — |
D | 水浴加热 | 6% | MnO2 |
A. A B. B C. C D. D