题目内容
【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
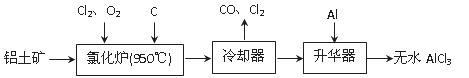
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。

(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
(1)Al2O3+3Cl2+3C 2AlCl3+3CO(2分)
2AlCl3+3CO(2分)
(2)SO32-+Cl2+H2O=SO42-+2Cl-+2H+(2分)
(3)除去FeCl3(2分)
(4)①Fe3++3OH-=Fe(OH)3↓(2分) Al3++4OH-=AlO2-+2H2O(2分)②96%(2分)
(5)在HCl气流中加热脱结晶水(2分)
(6)Fe3C+3O2 Fe3O4+CO2(1分)
Fe3O4+CO2(1分)
 2AlCl3+3CO(2分)
2AlCl3+3CO(2分)(2)SO32-+Cl2+H2O=SO42-+2Cl-+2H+(2分)
(3)除去FeCl3(2分)
(4)①Fe3++3OH-=Fe(OH)3↓(2分) Al3++4OH-=AlO2-+2H2O(2分)②96%(2分)
(5)在HCl气流中加热脱结晶水(2分)
(6)Fe3C+3O2
 Fe3O4+CO2(1分)
Fe3O4+CO2(1分)试题分析:⑴在氯化炉中发生的反应物有Al2O3、Cl2、C,生成物有AlCl3、CO(在冷却器中逸出),根据氧化还原反应的配平方法将其配平,并写出反应条件(950℃);
⑵书写Na2SO3溶液与Cl2反应的离子方程式时,先根据得失电子守恒有SO32-+Cl2――SO42-+2Cl-,再根据电荷守恒有SO32-+Cl2――SO42-+2Cl-+2H+,最后根据原子守恒得SO32-+Cl2+H2O=SO42-+2Cl-+2H+。
⑶由于升华器中含有AlCl3和FeCl3(杂质),加入少量Al,可与FeCl3反应将其除去。
⑷在含有FeCl3杂质的AlCl3产品中加入过量的NaOH溶液所发生的离子方程式有①Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O;沉淀物[Fe(OH)3]经洗涤、灼烧、冷却、称重,残留固体(Fe2O3)质量为0.32 g,据原子守恒可计算AlCl3产品的纯度:
 。
。⑸为了抑制AlCl3的水解,必须在在HCl气流中加热AlCl3·6H2O,使其脱结晶水(否则会生成Al(OH)3或Al2O3)。
⑹据题意该反应的生成物有Fe3C、O2(空气),生成物有Fe3O4(磁性的固体)、CO2,根据氧化还原反应的配平方法将其配平,并标出反应条件(高温)。

练习册系列答案
相关题目