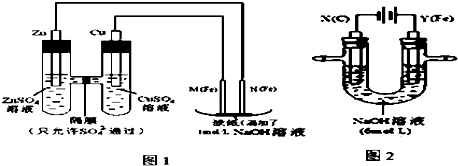
题目内容
14.已知NaBiO3溶液呈无色,Bi3+在溶液中比较稳定且为无色.取一定量用稀硫酸酸化的MnSO4溶液依次进行下列实验,有关现象记录如下:①滴加适量NaBiO3溶液,溶液呈紫红色;
②再加入过量的H2O2溶液,紫红色消失,产生气泡;
③最后加入适量KI淀粉溶液.
请回答下列问题:
(1)NaBiO3、KMnO4、H2O2、I2氧化性由强到弱的顺序为NaBiO3>KMnO4>H2O2>I2.
(2)实验③中的现象为溶液变蓝色.
(3)实验①、②中反应的离子方程式分别是5BiO3-+2Mn2++14H+═5Bi3++2MnO4-+7H2O,5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑.
(4)实验②中若产生标准状况下2.24L气体,则转移的电子数为0.2NA.
分析 (1)根据发生的反应中,氧化剂的氧化性大于氧化产物的氧化性这一规律来回答判断;
(2)KMnO4氧化SO2气体生成SO42-,自身被还原为Mn2+,SO42-和③中生成的Pb2+反应生成白色沉淀;
(3)稀硫酸酸化的MnSO4溶液,加入适量的NaBiO3,溶液变为紫红色,发生氧化还原反应生成高锰酸根离子和Bi3+、水;高锰酸钾与双氧水反应生成锰离子、水和氧气;
(4)实验②中O元素的化合价从-1价升高到0价,结合反应方程式计算.
解答 解:(1)根据氧化剂的氧化性大于氧化产物的氧化性,
由①中现象可知:NaBiO3把Mn2+氧化生成MnO4-,则NaBiO3(氧化剂)的氧化性强于KMnO4(氧化产物)的氧化性;
由②中现象可知:KMnO4氧化H2O2产生O2,自身被还原为Mn2+,则KMnO4(氧化剂)的氧化性强于H2O2的氧化性;
由③中现象可知:碘离子被双氧水氧化成单质碘,则双氧水(氧化剂)的氧化性强于碘单质(氧化产物)的氧化性,
综上所述,NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序是:NaBiO3>KMnO4>H2O2>I2,
故答案为:NaBiO3>KMnO4>H2O2>I2;
(2)②中加入过量的H2O2溶液,③加入适量KI淀粉溶液,KI被氧化为碘单质,溶液变蓝色;
故答案为:溶液变蓝色;
(3)稀硫酸酸化的MnSO4溶液,加入适量的NaBiO3,溶液变为紫红色,发生氧化还原反应生成高锰酸根离子和Bi3+、水,其离子方程式为:5BiO3-+2Mn2++14H+═5Bi3++2MnO4-+7H2O,高锰酸钾与双氧水反应生成锰离子、水和氧气,其离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑;
故答案为:5BiO3-+2Mn2++14H+═5Bi3++2MnO4-+7H2O;5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑;
(4)实验②5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑中O元素的化合价从-1价升高到0价,产生标准状况下2.24L气体,即生成0.1mol氧气,则转移电子为0.2mol,即0.2NA个.
故答案为:0.2NA.
点评 本题考查离子反应和氧化还原反应,明确发生的反应及反应中元素的化合价变化是解答的关键,注意利用电子守恒计算时氧元素由-1价升高为0为易错点,题目难度中等.

 阅读快车系列答案
阅读快车系列答案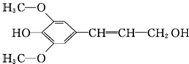 膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇的分子式是C11H12O4 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面 | |
| C. | 芥子醇能与FeCl3溶液发生显色反应 | |
| D. | 1mol芥子醇能与足量溴水反应消耗3mol Br2 |
| A. | 用湿润的pH试纸测定溶液的pH,所测pH一定不准 | |
| B. | 使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 | |
| C. | 使湿润的红色石蕊试纸褪色的气体必然是SO2 | |
| D. | 用湿润的红色石蕊试纸检验NH3 |
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去.则下列关于镁与溴水的反应机理的论述中正确的是( )
| A. | 镁粉只直接与溴水中的溴反应 | |
| B. | 镁粉在水的催化下与溴发生反应 | |
| C. | 产生极少量的气泡是由于镁粉与水反应得到 | |
| D. | 镁粉只与溴水中的酸反应 |
| 混合物成分 | 化学试剂 | 离子方程式 |
| Na2SO4中含有少量Na2CO3杂质 | ||
| FeCl2中含有少量FeCl3杂质 | ||
| NaNO3中含有少量NaCl杂质 |
| A. | CsICI2有氧化性,是因为Cs显+3价 | |
| B. | CsICI2有还原性,是因为含有较强还原性的I- | |
| C. | 酸性高锰酸钾溶液中滴加CsICI2溶液,溶液褪色 | |
| D. | 在CsICl2溶液中滴加HNO3,可生成Cl2 |