题目内容
9.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去.则下列关于镁与溴水的反应机理的论述中正确的是( )
| A. | 镁粉只直接与溴水中的溴反应 | |
| B. | 镁粉在水的催化下与溴发生反应 | |
| C. | 产生极少量的气泡是由于镁粉与水反应得到 | |
| D. | 镁粉只与溴水中的酸反应 |
分析 A、根据实验③将镁粉放入液溴中,未观察到任何明显现象来回答;
B、根据实验④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去来回答;
C、根据实验①将镁粉投入冷水中,未见任何现象来回答;
D、根据实验②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去来回答.
解答 解:A、根据实验③将镁粉放入液溴中,未观察到任何明显现象知:镁粉不会直接与溴水中的溴反应,故A错误;
B、根据实验④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去可以知道:镁粉和溴单质的反应需要在水的催化下进行,故B正确;
C、根据实验①将镁粉投入冷水中,未见任何现象可知:镁粉与冷水不能发生反应,故C错误;
D、根据实验②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,说明镁粉只与溴水中的部分酸反应,但是溴水的颜色褪去,说明溴单质参与了反应,故D错误.
故选B.
点评 本题考查学生金属镁和溴发生发应的机理的问题,要求学生善于分析已知信息,灵活应用所学知识,题目难度不大.

练习册系列答案
相关题目
14.下列叙述正确的是( )
| A. | 煤的干馏和石油的分馏均属化学变化时,煤的气化和液化属于物理变化 | |
| B. | 溶液和胶体的本质区别是丁达尔效应 | |
| C. | 有单质参加和生成的化学反应一定是氧化还原反应 | |
| D. | 将浓度为18.4mol/L质量分数为98%的浓硫酸加水稀释至9.2 mol/L,则稀释后溶质的质量分数大于49% |
20.某盐的混合物中含有0.2mol Na+、0.4mol Mg2+、0.4mol Cl -,则SO42-为( )
| A. | 0.1 mol | B. | 0.3 mol | C. | 0.5 mol | D. | 0.15 mol |
17.2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究.下列关于
${\;}_{78}^{202}$Pt的说法正确的是( )
${\;}_{78}^{202}$Pt的说法正确的是( )
| A. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质子数相同,互称为同位素 | |
| B. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的中子数相同,互称为同位素 | |
| C. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt是同一种核素 | |
| D. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质量数不同,不能互称为同位素 |
1.除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是( )
| 物质 | 杂质 | 除杂质应选用的试剂和操作方法 | |
| A | CO2 | CO | 通入O2,点燃 |
| B | NaOH固体 | Na2CO3固体 | 加入过量盐酸,蒸发 |
| C | Cu(NO3)2溶液 | AgNO3溶液 | 加入过量的铜粉,过滤 |
| D | KNO3溶液 | KOH溶液 | 加入适量的CuSO4溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
18.某研究性学习小组设计除去锅炉水垢(CaCO3、Mg(OH)2、CaSO4)的实验,查找各物质的溶解度数据如下.
设计流程如下(所加的试剂均过量):
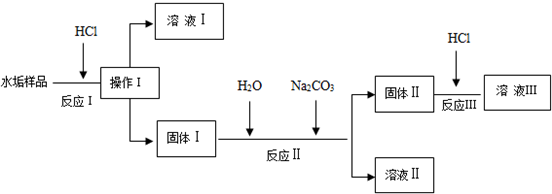
(1)操作Ⅰ的名称是过滤.
(2)溶液Ⅰ和溶液Ⅲ都含有的溶质是HCl、CaCl2.
(3)写出发生在上述过程中符合“盐+酸=另一种盐+另一种酸”特征的反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
写出反应Ⅱ的离子方程式CaSO4+CO32-=CaCO3+SO42-.
(4)上述过程中哪一步反应是利用了上述溶解度表设计的B.
A.反应ⅠB.反应ⅡC.反应Ⅲ
(5)溶液Ⅱ中的含氧酸根的检验方法是:取少量溶液II,先加盐酸无现象,再加氯化钡生成白色沉淀,则证明含硫酸根离子.
| 化学式 | CaSO4 | CaCO3 | Ca(OH)2 | CaCl2 |
| 溶解度/g | 0.21 微溶 | <0.01 | 0.077 | 74.5 |

(1)操作Ⅰ的名称是过滤.
(2)溶液Ⅰ和溶液Ⅲ都含有的溶质是HCl、CaCl2.
(3)写出发生在上述过程中符合“盐+酸=另一种盐+另一种酸”特征的反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
写出反应Ⅱ的离子方程式CaSO4+CO32-=CaCO3+SO42-.
(4)上述过程中哪一步反应是利用了上述溶解度表设计的B.
A.反应ⅠB.反应ⅡC.反应Ⅲ
(5)溶液Ⅱ中的含氧酸根的检验方法是:取少量溶液II,先加盐酸无现象,再加氯化钡生成白色沉淀,则证明含硫酸根离子.