题目内容
20.下列离子方程式不正确的是( )| A. | 向烧碱溶液中通入少量的二氧化碳 2OH-+CO2=CO32-+H2O | |
| B. | 向氯化铝溶液中滴加过量浓氨水 Al3++3OH-═Al(OH)3↓ | |
| C. | 向水玻璃中通入少量二氧化碳 SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| D. | 铝与氢氧化钠溶液反应 2Al+2OH-+6H2O═2AlO2-+3H2↑ |
分析 A.NaOH溶液中通入少量CO2反应生成碳酸钠和水;
B.氨水为弱碱,一水合氨不能拆开,应该保留分子式;
C.水玻璃为硅酸钠溶液,二氧化碳少量,反应生成硅酸沉淀和碳酸根离子;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:A.烧碱为氢氧化钠,二氧化碳少量,反应生成碳酸钠和水,反应的离子方程式为:2OH-+CO2=CO32-+H2O,故A正确;
B.向氯化铝溶液中滴加过量浓氨水,一水合氨不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.向水玻璃中通入少量二氧化碳,反应生成硅酸和碳酸根离子,反应的离子方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-,故C正确;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+6H2O═3H2↑+2AlO2-,故D正确;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式中常见的需要保留化学式的物质,如:弱电解质、难溶物、氧化物等,试题侧重考查学生灵活应用基础知识的能力.

练习册系列答案
相关题目
15.有些商贩为了使银耳增白,就用硫磺(燃烧硫磺)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的.这些不法商贩制取银耳利用的是( )
| A. | S的漂白性 | B. | S的氧化性 | C. | SO2的漂白性 | D. | SO2的还原性 |
8.下列关于甲、乙、丙、丁四种有机物说法正确的是( )


| A. | 四种物质中分别加入氯水,均有红棕色液体生成 | |
| B. | 四种物质中加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成 | |
| C. | 四种物质中加入NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成 | |
| D. | 乙发生消去反应得到两种烯烃 |
15.下列说法正确的是( )
①新制氯水的氧化性强于久置氯水;
②氯气的性质活泼,它与氢气混合后立即发生爆炸;
③实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收
④检验Cl2中是否混有HCl气体,方法是将气体通入硝酸银溶液中
⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水
⑥干燥的Cl2能使湿润的有色布条褪色,说明干燥的Cl2有漂白性.
①新制氯水的氧化性强于久置氯水;
②氯气的性质活泼,它与氢气混合后立即发生爆炸;
③实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收
④检验Cl2中是否混有HCl气体,方法是将气体通入硝酸银溶液中
⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水
⑥干燥的Cl2能使湿润的有色布条褪色,说明干燥的Cl2有漂白性.
| A. | ①②③④⑤⑥ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①③⑤ |
5.常温下,浓度均为0.l mol/L的下列四种盐溶液,其pH测定如下表所示:
下列说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A. | 四种溶液中,水的电离程度①>②>④>③ | |
| B. | Na2CO3和NaHCO3 溶液中,粒子种类相同 | |
| C. | 将等浓度的CH3COOH 和HClO溶液比较,pH小的是HClO | |
| D. | Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
12.下列有机物同分异构体数目判断错误的是( )
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C5H12 | 3 |
| B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2,能与NaHCO3反应 | 3 |
| A. | A | B. | B | C. | C | D. | D |
10.干燥剂的干燥性能可用干燥干燥效率(1m立方空气中实际余留水蒸气的质量)来衡量.某些干燥剂的干燥效率如下:
根据以上数据,有关叙述错误的是( )
| 物质 | MgO | CaO | ZnCl2 | ZnBr2 |
| 干燥效率 | 0.008 | 0.2 | 0.8 | 1.1 |
| A. | MgO 的干燥性能比CaO差 | |
| B. | 干燥效率可能与干燥剂的阴阳离子半径大小有关 | |
| C. | MgCl2可能是比CaCl2更好的干燥剂 | |
| D. | 上述干燥剂中阳离子对干燥性能的影响比阴离子大 |

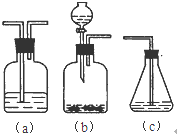
 (填字母符号)
(填字母符号)