题目内容
5.常温下,浓度均为0.l mol/L的下列四种盐溶液,其pH测定如下表所示:| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A. | 四种溶液中,水的电离程度①>②>④>③ | |
| B. | Na2CO3和NaHCO3 溶液中,粒子种类相同 | |
| C. | 将等浓度的CH3COOH 和HClO溶液比较,pH小的是HClO | |
| D. | Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
分析 酸性越弱,其酸根离子水解程度越大,对应的盐溶液的pH越大;
A、易水解的盐能促进水的电离;
B、根据溶液中的电离和水解平衡分析;
C、对应的盐溶液的pH越大,酸根离子水解程度越大,酸越弱;
D、根据物料守恒分析.
解答 解:酸性越弱,其酸根离子水解程度越大,对应的盐溶液的pH越大;
A、易水解的盐能促进水的电离,水解程度越大,对水的电离的促进程度越大,则四种溶液中,水的电离程度③>④>②>①,故A错误;
B、碳酸钠中CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,H2O?H++OH-,碳酸氢钠溶液中HCO3-?CO32-+H+,HCO3-+H2O?H2CO3+OH-,H2O?H++OH-,所以两种溶液中粒子种类相同,故B正确;
C、对应的盐溶液的pH越大,酸根离子水解程度越大,酸越弱,则将等浓度的CH3COOH和HClO溶液,CH3COOH的酸性强,则pH小的是CH3COOH,故C错误;
D、Na2CO3溶液中Na元素的物质的量是C元素的物质的量的2倍,则$\frac{1}{2}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故D错误;
故选B.
点评 本题考查了盐的水解、影响水的电离的程度的因素、物料守恒的应用等,注意根据酸性越弱,其酸根离子水解程度越大,对应的盐溶液的pH越大,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.铝制器皿能够盛放的物质是( )
| A. | 稀硝酸 | B. | 浓硫酸 | C. | NaOH溶液 | D. | 稀硫酸 |
20.下列离子方程式不正确的是( )
| A. | 向烧碱溶液中通入少量的二氧化碳 2OH-+CO2=CO32-+H2O | |
| B. | 向氯化铝溶液中滴加过量浓氨水 Al3++3OH-═Al(OH)3↓ | |
| C. | 向水玻璃中通入少量二氧化碳 SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| D. | 铝与氢氧化钠溶液反应 2Al+2OH-+6H2O═2AlO2-+3H2↑ |
10.常温下,在下列指定条件的各溶液中,一定能大量共存的离子组是( )
| A. | 含0.1 mol.L-1SO2的溶液.中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、N03-、SO42- | |
| C. | $\frac{C{(H}^{+})}{C({OH}^{-})}$=10-12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、ClO-、I- |
17.下列解释事实的离子方程式不正确的是( )
| A. | SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- | |
| B. | 利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 向淀粉碘化钾溶液中加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2=2I2+2H20 | |
| D. | 用盐酸洗涤试管中的Cu(OH)2:Cu(OH)2+2H+=Cu2++2H2O |
15.下列溶液中,有关物质的量浓度关系正确的是( )
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| B. | 1.0 mol•L-1Na2C2O4溶液:c(OH-)=c(HC2O4-)+c(H+)+c(H2C2O4) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:c(OH-)+c(A-)=c(H+)+c(HA) |
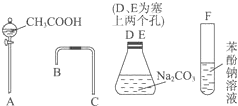 设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.
设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH. .
.