题目内容
卤族元素的单质和化合物很多。
(1)卤素原子与氢原子形成的共价键中,极性最强键的是_____。NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是______。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(3)CH3Cl、BF3、SCl2三种分子中属于极性分子的是 ,ClO2-中心氯原子的杂化轨道类型为______,写出一种与SO32-互为等电子体的分子 。
(4)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻最近的 两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
(1)H-F(1分) MgF2﹥NaF﹥SiF4 (2分)
(2)A (2分)
(3)CH3Cl、SCl2(2分) sp3杂化(2分) PCl3(或NCl3等)(2分)
(4) (2分)
(2分)
解析试题分析:(1)由于形成共用电子对的两元素的非金属性强弱相差越大,形成的共价键的极性越强;卤素原子与氢原子形成的共价键中,都含有氢原子,其它元素的非金属性大小关系为:F>Cl>Br>I,所以极性键的极性大小关系为:H-F>H-Cl>H-Br>H-I;NaF MgF2为离子晶体所以熔点高于分子晶体SiF4,在离子晶体中,离子的半径越小,晶格能越大;阴、阳离子所带电荷越多,晶格能越大,则晶体的熔点越高;电荷的影响大于半径的影响,所以NaF、MgF2、SiF4三种晶体的熔点从高到低的顺序是MgF2﹥NaF﹥SiF4。
(2)加热多卤化物则离解为简单的卤化物和卤素单质。CsBr3=CsBr+Br2,若为多种卤素的多卤化物,则离解生成具有最高晶格能的一种卤化物,如:CsICl2=CsCl+ICl,而不是CsI+Cl2,所以选A。
(3)组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子,所以BF3属于非极性分子,SCl2属于极性分子,CH3Cl空间结构为四面体形,不是正四面体,正负电荷的中心不重合,属于极性分子。ClO2-中价层电子对个数=2+1/2(7+1-2×2)=2,且含有2个孤电子对,所以空间构型是V型,sp3杂化;等电子体是指具有相同电子数目和原子数目的分子或离子,SO32-中有4个原子,6+6×3+2=26个价电子。
(4)该晶胞中含有钙离子个数=1/8×8+6×1/3 =4,氟离子个数=8,,相邻最近的两个Ca2+的核间距是正方体对角线的一半,所以正方体的边长为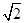 a cm,ρ=
a cm,ρ= 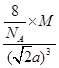 ,所以CaF2的相对分子质量可以表示为
,所以CaF2的相对分子质量可以表示为 。
。
考点:考查物质结构和性质。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案下列说法中正确的是( )
| A.分子中键能越大,键长越长,则分子越稳定 |
| B.元素周期表中的第ⅠA族(除H外)和第ⅦA族元素的原子间不能形成共价键 |
| C.水分子可表示为HO—H,分子中键角为180° |
| D.H—O键键能为463 kJ·mol-1,即18gH2O分解成H2和O2时,消耗能量为926kJ |
三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为 。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 (填“s”“P” “d”或“ds”等)区元素,位于 族。若T为第2周期元素,F是第3周期元素中原子半径最小的元素,则T与F形成化合物的空间构型为 ,其中心原子的杂化方式为 。
下面有关晶体的叙述中,不正确的是( )
| A.金刚石为空间网状结构,由共价键形成的碳原子环上,最小的环上有6个碳原子 |
| B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 |
| C.氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
据报道,国外科学家用激光将置于铁室中石墨靶上的碳原子炸松,再用射频电火花喷射
氮气,此时碳氮原子结合成碳氮化合物的薄膜,此化合物熔点比金刚石更高,其原因是( )
| A.碳氮化合物的分子间作用力大于金刚石 |
| B.氮原子最外层电子数比碳原子最外层电子数多 |
| C.碳、氮原子构成网状结构的晶体,碳氮键比金刚石中碳碳键更短 |
| D.碳、氮单质的化学性质均不活泼 |
